إشعاع دينيسوف دي إس التجسيمي. العلاج الإشعاعي التجسيمي. العلاج الإشعاعي المعدل بكثافة الشعاع
اقرأ أيضا
2
1 معهد MIBS الطبي. بيريزينا سيرجي ، سانت بطرسبرغ ؛ FGBOU VO SZGMU لهم. I. I. Mechnikov من وزارة الصحة الروسية ، سان بطرسبرج
2 LDC MIBS LLC ، سانت بطرسبرغ
3 جامعة ولاية سانت بطرسبرغ ، سانت بطرسبرغ
رقم 4 المركز العلمي الروسي للأشعة والتقنيات الجراحية الذي يحمل اسم N.N. أكاد. صباحا. Granov »من وزارة الصحة الروسية ، سان بطرسبرج
5 LDC MIBS LLC ، سانت بطرسبرغ
لا يزال علاج تكرار الإصابة بسرطان الرأس والعنق محليًا وإقليميًا يمثل مشكلة مهمة في علاج الأورام نظرًا لتكرار تطورها بعد العلاج المركب والمعقد. العلاج الجراحي غير ممكن في جميع الحالات ، والعلاج الكيميائي غير فعال للغاية ، وتتميز إعادة التشعيع باستخدام التقنيات التقليدية بمعدلات منخفضة من التحكم الموضعي ، والبقاء بشكل عام ، وخطر الإصابة بمضاعفات متأخرة شديدة. ضرر إشعاعي. أثبت العلاج الإشعاعي التجسيمي في نمط نقص التجزئة نفسه في علاج عدد من الأورام الأولية في المراحل المبكرة (سرطان الرئة وسرطان البروستاتا) ، وكذلك العلاج الملطف للآفات المنتشرة في الرئتين والكبد والعظام والغدد الليمفاوية. يتميز هذا النوع من العلاج الإشعاعي بتحمل جيد وكفاءة عالية نسبيًا ، ومع ذلك ، لا توجد حاليًا توصيات واضحة بشأن اختيار نظام التجزئة والجرعة الإجمالية والجرعات المتسامحة للأنسجة الطبيعية في حالة العلاج الإشعاعي التجسيمي في المناطق المشععة سابقًا . تأخذ المراجعة في الاعتبار استخدام العلاج الإشعاعي التجسيمي في وضع نقص التجزئة لعلاج التكرار الموضعي والإقليمي لسرطان الرأس والرقبة في المناطق التي سبق تعرضها للإشعاع.
الكلمات الدالة:سرطان الرأس والرقبة ، العلاج الإشعاعي ، الانتكاس ، العلاج الإشعاعي بالتوضيع التجسيمي ، نقص التجزئة.للاقتباس:ميخائيلوف إيه في ، فوروبيوف إن إيه ، سوكورينكو في بي ، مارتينوفا إن آي ، جوتسالو يو في. العلاج الإشعاعي التجسيمي في نمط نقص التجزئة في علاج أورام الرأس والرقبة المتكررة - حالة المشكلة // قبل الميلاد. المراجعة الطبية. 2018. №6. ص 22 - 27
العلاج الإشعاعي التجسيمي المنخفض في علاج أورام الرأس والرقبة المتكررة - حالة المشكلة
أ. ميخائيلوف 1،2 ، إن إيه فوروبيوف 1-3 ، ف. سوكورينكو 4 ، إن. Martynova 1، Yu.V. جوتسالو 1
تم تسمية المعهد الطبي رقم 1 على اسم Berezin Sergey (MIBS) ، St. بطرسبورغ
2 جامعة نورث ويسترن الطبية الحكومية سميت على اسم I. I. Mechnikov ، St. بطرسبورغ
3 شارع جامعة ولاية بطرسبورغ بطرسبورغ
4 سمي المركز العلمي الروسي للأشعة والتقنيات الجراحية باسم A.M. Granov ، St. بطرسبورغ
لا يزال علاج الانتكاسات الموضعية والإقليمية لسرطان الرأس والعنق يمثل مشكلة مهمة بسبب ارتفاع معدل تطورها بعد العلاج المركب والمعقد. العلاج الجراحي غير ممكن في جميع الحالات ، ويتميز العلاج الكيميائي بمعدلات شفاء منخفضة ، كما أن العلاج الإشعاعي باستخدام الطرق التقليدية يوفر معدلات منخفضة من التحكم الموضعي ، والبقاء بشكل عام ، وخطر كبير للإصابة بسمية شديدة في وقت متأخر من الإشعاع. يعتبر العلاج الإشعاعي التجسيمي ناقص التجزيء فعالاً في علاج الأورام الأولية في المراحل المبكرة (سرطان الرئة وسرطان البروستاتا) ، وكذلك في العلاج الملطف للأورام النقيلية في الرئتين والكبد والعظام والغدد الليمفاوية. يتميز هذا النوع من العلاج الإشعاعي بتحمل جيد وفعالية عالية نسبيًا ، ولكن لا توجد حاليًا توصيات واضحة لاختيار نظام تجزيئي ، ووصف جرعة إجمالية ، وجرعات متسامحة للأنسجة الطبيعية في حالة العلاج الإشعاعي التجسيمي في العلاج الإشعاعي سابقًا المناطق. تقدم هذه المراجعة الخبرة الحالية في العلاج الإشعاعي بالتوضيع التجسيمي الخالي من الكسر من أجل معالجة الانتكاسات المحلية والإقليمية لسرطان الرأس والرقبة في المناطق المشععة سابقًا.
الكلمات الدالة:سرطان الرأس والرقبة ، إعادة الإشعاع ، النكس ، العلاج الإشعاعي بالتوضيع التجسيمي ، نقص التجزئة.للاقتباس:ميخائيلوف إيه في ، فوروبيوف إن إيه ، سوكورينكو ف. في آل. العلاج الإشعاعي التجسيمي المفرط في علاج أورام الرأس والرقبة المتكررة - حالة المشكلة // RMJ. المراجعة الطبية. 2018. رقم 6. ص 22-27.
تأخذ المراجعة في الاعتبار استخدام العلاج الإشعاعي التجسيمي في وضع نقص التجزئة لعلاج التكرار الموضعي والإقليمي لسرطان الرأس والرقبة في المناطق التي سبق تعرضها للإشعاع.
مقدمة
بعد العلاج الجذري الناجح للأشكال المتقدمة محليًا من سرطان الرأس والعنق ، تتطور التكرارات الموضعية في أكثر من 30٪ من المرضى. الطريقة المثلى لعلاج المرضى الذين يعانون من سرطان الرأس والعنق المتكرر هي الجراحة ، حيث توفر 36 ٪ بدون انتكاسات لمدة عامين و 39 ٪ لمدة خمس سنوات بشكل عام ، ومع ذلك ، لا يمكن إجراء أكثر من 20 ٪ من المرضى بسبب ما هو واضح. - تغيرات إشعاعية في الأنسجة الرخوة للرقبة ، وقرب الورم المتكرر من الأوعية الرئيسية وشديد ما يصاحب ذلك من علم الأمراض.يتم تحقيق الاستجابة للعلاج الجهازي (العلاج الكيميائي ، العلاج الموجه) في 15-25٪ من المرضى ، والبقاء الخالي من الانتكاس والبقاء بشكل عام هو
5.6 و 10.5 شهرًا على التوالى .
قبل ظهور تقنيات التشعيع عالية الدقة ، خضع المرضى الذين يعانون من تكرار غير قابل للجراحة لأورام الرأس والعنق للعلاج الإشعاعي المتكرر باستخدام التجزئة التقليدية باستخدام تقنيات التخطيط ثنائية وثلاثية الأبعاد ، ونادرًا ما تتجاوز الجرعة الإجمالية 50 جراي. العيب الرئيسي لاستخدام العلاج الإشعاعي التقليدي المتكرر هو السمية الإشعاعية المتأخرة من الدرجة الثالثة إلى الرابعة ، والتي تتطور في أكثر من 30٪ من المرضى. وفقًا للأدبيات ، بعد العلاج الإشعاعي التقليدي المتكرر المنافس للعلاج الكيميائي ، تسبب تطور المرض في وفاة 90٪ من المرضى. توفي حوالي 10 ٪ من المرضى بسبب المضاعفات المرتبطة بالعلاج ، ولم يتجاوز معدل البقاء على قيد الحياة لمدة خمس سنوات 6 ٪.
تشير هذه البيانات المخيبة للآمال إلى الحاجة إلى إيجاد طرق جديدة لعلاج هذه الفئة من المرضى ، وإحدى هذه الطرق هي طرق العلاج الإشعاعي المطابقة مع تصعيد الجرعة الإجمالية لتحسين التحكم المحلي والبقاء بشكل عام دون المساس بنوعية حياة المرضى.
العلاج الإشعاعي التجسيمي (SLT) في وضع نقص التجزئة هو طريقة حديثة للعلاج الإشعاعي ، حيث يتم تسليم جرعات عالية من الإشعاع المؤين (أكثر من 3 غراي لكل جزء) إلى المنطقة المستهدفة في عدد قليل من الكسور (من 2 إلى 5). يتم العلاج وعملية التحضير له باستخدام أجهزة تثبيت خاصة (مساند الرأس ، أقنعة مصنوعة من مادة لدن بالحرارة ، مراتب مفرغة من الهواء) ، تقنيات تخطيط قياس الجرعات عالية المطابقة (IMRT - العلاج الإشعاعي المعدل الشدة ، VMAT - العلاج القوسي المعدل بالحجم ) ، مع التحكم في الأوضاع العلاجية باستخدام التصوير بالأشعة السينية على مسرعات خطية حديثة ، مما يجعل من الممكن توفير الدقة المطلوبة للإشعاع.
تشتمل مزايا SLT في وضع نقص التجزئة على مسار علاجي أقصر مقارنةً بالتجزئة القياسية ، والجرعة عالية الفعالية بيولوجيًا ، وعدد أقل من الكسور ، مما يزيد من فعالية العلاج عن طريق تقليل تأثير ظاهرة إعادة تكاثر الورم ، وفي بعض الحالات الحالات ، تسمح بالحصول على نتائج مرضية عند تعريض الأورام المقاومة للإشعاع. يتيح لنا ذلك اعتبار التشعيع بالتوضيع التجسيمي إحدى طرق علاج المرضى المصابين بسرطان الرأس والعنق المتكرر.
نقص التجزئة في العلاج الأولي لمرضى أورام الرأس والرقبة
تمت دراسة استخدام الجرعات المفردة العالية منذ الثمانينيات. وهكذا ، في عام 1982 ، Weissberg et al. نشر نتائج دراسة استباقية أجريت على أساس جامعة ييل ، حيث تم استخدام العلاج الإشعاعي باستخدام جرعات مفردة عالية لأغراض ملطفة في علاج الأورام الخبيثة في الرأس والرقبة منذ عام 1973. تم تقسيم المرضى بشكل عشوائي إلى مجموعتين. تم تعريض مرضى المجموعة الأولى للإشعاع بجرعة واحدة من 2 جراي إلى جرعة إجمالية 60-70 جراي لمدة 6-7 أسابيع ، المجموعة الثانية - 4 جراي بجرعة إجمالية قدرها 44 جراي لمدة 2-3 أسابيع. تم إجراء العلاج باستخدام أشعة الشمس مع طاقة فوتون من 2-6 مللي فولت. غالبية المرضى (94٪ و 88٪ في المجموعتين الأولى والثانية على التوالي) لديهم مرحلة T4 من المرض. تميزت كلتا المجموعتين بتحمل وفعالية قابلة للمقارنة. كانت نسبة البقاء على قيد الحياة لمدة خمس سنوات خالية من الانتكاس 10٪ في كلا المجموعتين.يصف الأدب تقنية "الحقن الرباعي" (الإنجليزية - "أربع طلقات") ، المستخدمة لأغراض ملطفة للمرضى الذين يعانون من عملية متقدمة محليًا في الرأس والرقبة. تم استخدام نظام التجزئة التالي: 14 جراي لأربعة كسور ، 2 ص / يوم بفاصل زمني
06:00. ثم تكرر هذا النظام على فترات 4 أسابيع لدورتين أخريين. في الوقت نفسه ، لوحظ الحد الأدنى من السمية وتحسين نوعية الحياة. كانت الاستجابة الموضوعية للعلاج الإشعاعي 53٪ ، وتحقق استقرار العملية في 23٪ من المرضى. كان متوسط البقاء الإجمالي 5.7 شهرًا ، وكان متوسط PFS 3.1 شهرًا.
النتائج المنشورة في 1990 من قبل Ang et al. أشارت الدراسة إلى سلامة وفعالية جرعة واحدة من 5 جراي وما فوق في مرضى سرطان الجلد في الرأس والرقبة. تم اختيار جرعة واحدة (6 كسور جراي × 5) بناءً على الخصائص الإشعاعية البيولوجية للورم الميلانيني. أظهر هؤلاء المرضى معدلات عالية من السيطرة الموضعية دون أي سمية إشعاعية متأخرة كبيرة.
مع تطور القدرات التقنية للعلاج الإشعاعي بالحزمة الخارجية ، جرت محاولات لاستخدام التشعيع التجسيمي بجرعة مفردة عالية كمكمل محلي (تعزيز) في مرضى سرطان البلعوم الأنفي بعد دورة من العلاج الإشعاعي في وضع التجزئة القياسي حتى جرعة إجمالية 66 غراي. بعد 4-6 أسابيع. بعد الانتهاء من مسار التشعيع بطريقة التجزئة التقليدية ، تم إعطاء جرعة واحدة من 7 إلى 15 غراي إلى منطقة البلعوم الأنفي. وفقًا لنتائج الدراسة ، لوحظت مؤشرات جيدة للسيطرة المحلية (100 ٪ تحكم محلي لمدة ثلاث سنوات) على خلفية التحمل المرضي والوقوع المقبول للضرر الإشعاعي المتأخر. وشملت الدراسة 45 مريضا ، تجلت سمية الإشعاع في شكل التهاب عصبي الأعصاب الدماغيةفي 4 مرضى ، اعتلال الشبكية بعد العلاج الإشعاعي - في مريض واحد وتنخر إشعاعي بدون أعراض في الفص الصدغي - في 3 مرضى.
الممغاني وآخرون الإبلاغ عن نتائج التشعيع الخفيف التجسيمي كمكمل محلي بعد دورة العلاج الإشعاعي بالحزمة الخارجية في طريقة التجزئة التقليدية في المرضى الذين يعانون من سرطان الخلايا الحرشفية في البلعوم الفموي وتجويف الفم ، والذين تلقوا عادةً دفعة باستخدام المعالجة الكثبية التلامسية أو الخلالية. بعد الوصول إلى الجرعة الإجمالية في طريقة التجزئة المعيارية ، تم إجراء التشعيع الموضعي للورم الأولي بجرعة واحدة 5.5 غراي حتى جرعة إجمالية 16.5 غراي.
(لثلاثة كسور). كانت معدلات البقاء على قيد الحياة لمدة عامين وخالية من الأمراض والإجمالية 86 ٪ و 80 ٪ و 82 ٪ على التوالي. لم يتم تسجيل الانقطاعات في العلاج ، ولم يتم ملاحظة سمية الإشعاع المبكرة من الدرجة الرابعة وما فوق. تطورت سمية الإشعاع المتأخر خلال فترة متابعة مدتها سنتان في 28 ٪ من المرضى. استنتج المؤلفون أن التشعيع التجسيمي كمكمل محلي فعال للغاية وآمن مقارنة بالمعالجة الكثبية.
بدأت التجربة الإيجابية لاستخدام SLT في العلاج الأولي لسرطان الرأس والرقبة من حيث الفعالية والأمان في علاج الأورام بدراسات حول استخدام هذه الطريقة للتشعيع المتكرر للمرضى الذين يعانون من انتكاسات أورام خبيثة في الرأس والرقبة.
الإشعاع التجسيمي المتكرر في وضع نقص التجزئة لسرطان الرأس والعنق المتكرر
تتمثل أخطر مضاعفات العلاج الإشعاعي في حدوث ضرر لا رجعة فيه للجهاز العصبي المركزي. تكمن صعوبة تشعيع منطقة الرأس والرقبة في قرب الأحجام المشعة من الهياكل الحرجة مثل جذع الدماغ ، والحبل الشوكي ، والأعصاب البصرية ، والقوقعة ، والعصب السمعي ، والأضرار التي تؤدي إلى عواقب مميتة أو تؤدي إلى تدهور كبير في جودة حياة المرضى. في الوقت الحالي ، لا توجد توصيات واضحة بشأن تكوين أحجام العلاج الإشعاعي ووصف الجرعات للعلاج الإشعاعي المتكرر ، ولم يتم حل مشكلة الجرعات المتسامحة للأنسجة الطبيعية أثناء التشعيع المتكرر بشكل نهائي.يشير العديد من المؤلفين إلى أهمية التصوير الطبي في تكوين أحجام العلاج الإشعاعي. دور مهم للبوزيترون-
التصوير المقطعي المحوسب بالانبعاثات (PET ، PET-CT) باستخدام الجلوكوز في تحديد حدود الورم المتكرر على خلفية تغييرات الأنسجة بعد الإشعاع. ديانتونيو وآخرون. أظهر في دراستهم أن الحجم العياني للورم (حجم الورم الإجمالي - GTV) ، المتكون وفقًا لبيانات PET (GTV-PET) ، كان أقل من GTV ، المتكون وفقًا لبيانات CT (GTV-CT): 17.2 سم 3 مقابل 20.0 سم 3 التي لم تكن ذات دلالة إحصائية (ع = 0.2). ومع ذلك ، فإن الحجم السريري للهدف ، الذي تم تشكيله على أساس كلتا طريقتين التصوير ، كان أكبر بكثير من ذلك المحدد فقط من بيانات التصوير المقطعي المحوسب ، بسبب التحديد الأكثر دقة لحدود الورم المتكرر على خلفية تغييرات ما بعد الإشعاع في الأنسجة المحيطة.
يعتمد اختيار نظام التجزئة ووصف الجرعات الإجمالية على الجرعات المتسامحة للأنسجة الطبيعية المحيطة ويستند إلى معرفة البيولوجيا الإشعاعية للأورام. أثناء التشعيع الأولي والمتكرر ، غالبًا ما يتم استخدام جرعات مفردة من 6-9 جراي ، إجمالي - 30-54 جراي ، يختلف عدد الكسور من 2 إلى 7.
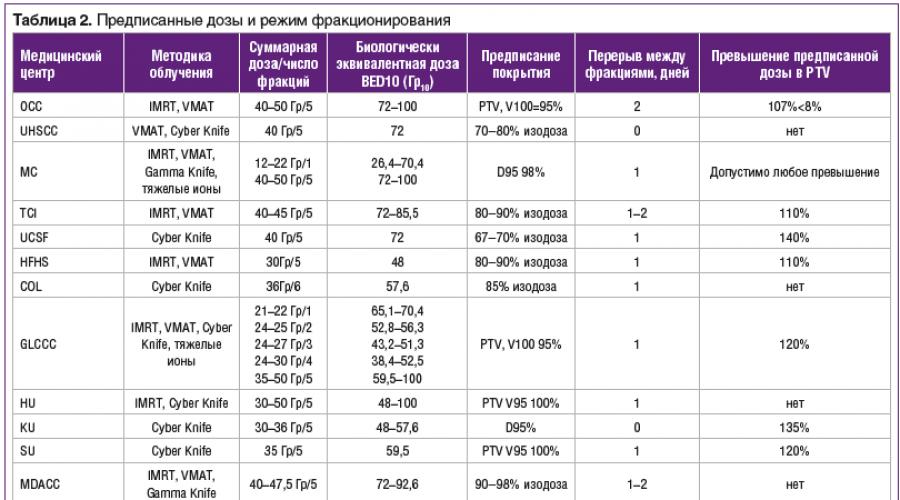
في أكبر عيادات الأورام في الولايات المتحدة الأمريكية وأوروبا واليابان ، تم اكتساب خبرة معينة في استخدام SLT في وضع نقص التجزئة مع التشعيع المتكرر لمنطقة الرأس والرقبة. لخص الاتحاد الدولي للعلاج الإشعاعي التجسيمي تجربة عيادات الأورام الرائدة في العالم ، وقد نُشرت نتائج هذه الدراسة في عام 2017. وترد البيانات الخاصة بتكوين أحجام العلاج الإشعاعي في العيادات المختلفة في الجدول 1.
وتجدر الإشارة إلى عدد قليل نسبيًا من الملاحظات والاختلافات الكبيرة في مناهج تشكيل الحجم المشع بين المراكز التي قدمت البيانات. في معظم الحالات ، تكون تعويضات تكوين الحجم المستهدف السريري (CTV) وحجم العلاج المخطط (PTV) صغيرة ، من 1 إلى 3 مم ، بسبب الدقة العالية لتعديل الجرعة على المعدات المستخدمة لتنفيذ العلاج الإشعاعي. في بعض العيادات ، يعتبر الالتزام بجرعات متسامحة للأنسجة الطبيعية أولوية ، بينما في حالات أخرى يكون هو تغطية الجرعة المستهدفة.
يوضح الجدول 2 بيانات العيادات المذكورة أعلاه حول وصف الجرعة الإجمالية ونظام التجزئة والوسائل التقنية لتنفيذ العلاج الإشعاعي. الأكثر شيوعًا هي دورات العلاج الإشعاعي ، بما في ذلك 5 إلى 6 جلسات من الإشعاع بجرعة إجمالية من 35-50 جراي ، وهو ما يعادل بيولوجيًا 48-100 جراي للمعامل α / β = 10 جراي. في عدد من المراكز ، كان يتم إجراء التشعيع يوميًا ، وفي مراكز أخرى - كل يومين أو كل يومين. من الضروري ملاحظة الاختلافات في نهج تخطيط التدرج. تم السماح للمراكز التي تستخدم أنظمة CyberKnife بتجاوز الجرعة الموصوفة في الهدف بنسبة تصل إلى 135٪ ، بينما في العيادات الأخرى التي تستخدم مسرعًا خطيًا مع موازاة متعددة الأوراق ، تم وصف تغطية متجانسة لحجم العلاج بجرعة زائدة لا تزيد عن 10 - عشرين٪.

يوضح الجدول 3 الجرعات المتسامحة للأنسجة الطبيعية لإعادة التشعيع في وضع نقص التجزئة ، والتي استرشدت بها العيادات التي شاركت في دراسة المسح. تعكس هذه الجرعات القيم المعممة ولا ينصح بها. يعود القرار للطبيب المعالج ، اعتمادًا على الحالة السريرية المحددة ، والجرعة التي يتلقاها عضو أو آخر أثناء التشعيع الأولي ، وكذلك الفترة الزمنية المنقضية بين دورات العلاج الإشعاعي.

يوضح الجدول 4 البيانات الخاصة بحدوث مضاعفات الإشعاع المتأخرة ، التي قدمتها العيادات التي شاركت في تلخيص تجربة التشعيع التجسيمي المتكرر.

مع التشعيع المتكرر ، حتى لو لوحظت الجرعات القصوى المسموح بها أعلاه ، هناك زيادة مضاعفة تقريبًا في حدوث المضاعفات مثل تنخر العظم وعسر البلع ونخر الأنسجة الرخوة. وتجدر الإشارة إلى أن نسبة حدوث النزيف القاتل من الشريان السباتي ، والتقرحات الإشعاعية ، والتهاب الغشاء المخاطي النزفي ، وتكون الناسور لا تختلف بشكل كبير عن تلك التي تحدث عند التعرض الأولي. يتفق المؤلفون على أن خطر النزيف من الشريان السباتي لا يعتمد على حجم الورم ، والاستجابة للعلاج والفاصل الزمني بين دورات التشعيع ، ولكن على درجة تغطية جدار الوعاء بالورم. تم العثور على ارتباط بين حدوث النزيف وتغطية الورم بأكثر من 180 درجة من محيط جدار الأوعية الدموية. يقارن الجدول 4 تواتر المضاعفات المتأخرة للعلاج الإشعاعي في النظام العلاجي ناقص التجزئة مع التشعيع الأولي والمتكرر للرأس والرقبة.
الجمع بين الإشعاع التجسيمي المتكرر في وضع نقص التجزئة لانتكاسات سرطان الرأس والرقبة مع العلاج الجهازي
تتمثل إحدى طرق التغلب على المقاومة الإشعاعية للورم المتكرر في استخدام مكون جهاز في نفس الوقت مع التشعيع الموضعي. نظرًا لاستخدام التثبيط الخلوي الكلاسيكي الفعال ، كقاعدة عامة ، بالفعل في علاج الورم الأولي ، يصبح العلاج الموجه هو الطريقة المفضلة. يعد سيتوكسيماب cetuximab أحد أفضل الأدوية المستهدفة التي تم دراستها لعلاج سرطان الخلايا الحرشفية في الرأس والرقبة. وتجدر الإشارة بشكل خاص إلى التجارب العشوائية التي أجراها فريق معهد السرطان في جامعة بيتسبرغ. في دراستهم ، هيرون وآخرون. تم اختيار المرضى بصورة عشوائية في SLT ناقص التجزئة (ن = 35) و SLT جنبا إلى جنب مع سيتوكسيماب الأسبوعي (ن = 35). تم الحصول على استجابة كاملة في 34.3٪ من المرضى الذين خضعوا لـ SLT وحده وفي 45.7٪ من المرضى الذين تلقوا علاجًا مشتركًا مع سيتوكسيماب cetuximab. كانت السيطرة الموضعية لمدة عام وسنتين 53.8٪ و 33.6٪ للمرضى الذين يعانون من SLT وحده ، و 78.6٪ و 49.2٪ على التوالي للمرضى الذين خضعوا للعلاج المشترك (p = 0.009). كان البقاء الإجمالي لمدة عام وسنتين 52.7٪ و 21.1٪ للمرضى الذين عولجوا باستخدام SLT وحده ، و 66٪ و 53.5٪ للمرضى الذين عولجوا بعلاج مركب ، على التوالي (p = 0.31).تم استخدام نتائج هذا العمل كأساس منطقي لفتح دراسة المرحلة الثانية لإعادة تشعيع أورام الرأس والعنق المتكررة باستخدام SLT في منافسة سيتوكسيماب. في هذه الدراسة ، تلقى 50 مريضا سيتوكسيماب
(400 مجم / م 2 في اليوم 7 و 240 مجم / م 2 في الأيام من 1 إلى 8) منافس لـ SLT المتكرر بجرعة إجمالية 40-44 Gy في 5 كسور. كان متوسط المتابعة 18 شهرًا. من بين المرضى الذين نجوا خلال فترة المراقبة هذه ، كانت نسبة البقاء على قيد الحياة لمدة عام واحد قبل التقدم المحلي 60٪ ، إقليم - 37٪ ، بعيد - 71٪. بلغ معدل البقاء على قيد الحياة لمدة عام واحد لجميع المرضى المشمولين في الدراسة 40٪. لوحظ التحمل الجيد للعلاج مع حدوث مضاعفات إشعاعية متأخرة من الدرجة الثالثة وأعلى في 6٪ من المرضى. خلص المؤلفون إلى أنه من الممكن أن بأمان و تطبيق فعالمن هذا النظام في العلاج الملطفة للمرضى الذين يعانون من سرطان الخلايا الحرشفية المتكرر في الرأس والرقبة.
استنتاج
حتى الآن ، يبدو أن العلاج الإشعاعي التوضيعي التجسيمي ، سواء بمفرده أو بالاشتراك مع عوامل جهازية ، هو علاج فعال وآمن نسبيًا للمرضى المصابين بسرطان الرأس والعنق المتكرر. يكشف تحليل التجربة المتراكمة حتى الآن في تطبيق هذه الطريقة عن عدم تجانس مجموعات المرضى المدروسة من حيث مقاربات تكوين أحجام التشعيع ، فضلاً عن وصف الجرعات المفردة والإجمالية ، والتي تملي الحاجة إلى مزيد من الدراسات حول تأثير هذه المعلمات على فعالية العلاج وتكرار وطبيعة المضاعفات الملحوظة.المؤلفات
1. Patel P. R.، Salama J.K. Reirradiation for recurrent head and neck cancer. Expert Rev. مضاد للسرطان هناك. 2012. المجلد. 12- ص 1177-1189.
2. ماكدونالد إم دبليو ، لوسون جيه ، جارج إم ك وآخرون. معايير ملاءمة ACR إعادة علاج سرطان الرأس والرقبة المتكرر بعد لجنة خبراء إشعاع نهائية مسبقة حول علاج الأورام الإشعاعي - سرطان الرأس والرقبة // Int. ي راديات. أونكول. بيول. فيز. 2011 المجلد. 80- ص 1292–1298.
3. Sokurenko V. P. و Mikhailov A. V. 2017. V.8. القضية. 1. ص 82 - 87.
4. جودوين دبليو جيه. جراحة الإنقاذ للمرضى المصابين بسرطان الخلايا الحرشفية المتكرر في الجهاز الهضمي العلوي: متى تبرر الغايات الوسيلة؟ // منظار الحنجرة. 2000 المجلد. 110. ملحق. 93- ص 1 - 18.
5. Clavel M. ، Vermorken J.B ، Cognetti F. et al. مقارنة عشوائية بين سيسبلاتين وميثوتريكسات وبليوميسين وفينكريستين (CABO) مقابل سيسبلاتين و 5 فلورويوراسيل (CF) مقابل سيسبلاتين (C) في سرطان الخلايا الحرشفية المتكرر أو النقيلي في الرأس والرقبة. دراسة المرحلة الثالثة للمجموعة التعاونية لسرطان الرأس والعنق EORTC // آن. أونكول. 1994 / المجلد. 5. ص 521-526.
6. ستروجان ب. ، كوري ج. ، إيسبروش إيه وآخرون. سرطان الخلايا الحرشفية الأساسي المتكرر والثاني للرأس والرقبة: متى وكيف يتم إعادة تشعيع // الرأس العنق. 2015. المجلد. 37. ص 134 - 150.
7. سبنسر إس إيه ، هاريس جيه ، ويلر آر إتش وآخرون. RTOG 96-10: إعادة الإشعاع باستخدام هيدروكسي يوريا و 5 فلورويوراسيل في المرضى المصابين بسرطان الخلايا الحرشفية في الرأس والرقبة // Int. رديات. أونكول. بيول. فيز. 2001 المجلد. 51. ص 1299-1304.
8. Le Q. T. ، Tate D. ، Koong A. et al. تحسين السيطرة المحلية مع تعزيز الجراحة الإشعاعية التجسيمي في المرضى الذين يعانون من سرطان البلعوم الأنفي // Int. رديات. أونكول. بيول. فيز. 2003 المجلد. 56. ص 1046-1054.
9. تيمرمان آر دي ، هيرمان جيه ، تشو إل سي ظهور العلاج الإشعاعي بالتوجه التجسيمي للجسم وتأثيره على الممارسة السريرية الحالية والمستقبلية // J. Clin. أونكول. 2014. المجلد. 32. ص 2847 - 2854.
10. Weissberg J.B، Son Y. H.، Percarpio B.، Fischer J. J. محاكمة عشوائية من العلاج الإشعاعي التقليدي مقابل جرعة كسور عالية في علاج سرطان الرأس والعنق المتقدم // كثافة العمليات. رديات. أونكول. بيول. فيز. 1982 المجلد. 8. ص 179 - 185.
11. Corry J.، Peters L.J، Costa I. D. et al. "QUAD SHOT" - دراسة المرحلة الثانية من العلاج الإشعاعي الملطف لسرطان الرأس والعنق المستعصي // Radiother Oncol. 2005 المجلد. 77- ص 137 - 142.
12. آنج ك ك ، بايرز آر إم ، بيترز إل جيه وآخرون. العلاج الإشعاعي الموضعي كعلاج مساعد لسرطان الرأس والعنق الخبيث. النتائج الأولية // القوس. Otolaryngol. جراحة الرأس والرقبة. 1990 المجلد. 116- ص 169 - 172.
13. Le Q. T. ، Tate D. ، Koong A. et al. تحسين السيطرة المحلية مع تعزيز الجراحة الإشعاعية التجسيمي في المرضى الذين يعانون من سرطان البلعوم الأنفي // Int. رديات. أونكول. بيول. فيز. 2003 المجلد. 56. ص 1046-1054.
14. الممجاني أ ، تانس إل ، تيجوه دي إن ، فان رويج ب وآخرون. العلاج الإشعاعي التجسيمي للجسم: خيار علاجي واعد لزيادة سرطانات الفم والبلعوم غير المناسبة للمعالجة الكثبية: تجربة مؤسسية واحدة // Int. رديات. أونكول. بيول. فيز. 2012. المجلد. 82- ص 1494-1500.
15. Roh K. W. ، Jang J. S. ، Kim M. S. et al. العلاج الإشعاعي التجسيمي المجزأ كإشعاع لسرطان الرأس والعنق المتكرر محليًا // Int. رديات. أونكول. بيول. فيز. 2009 المجلد. 74. ص 1348 - 1355.
16. Moule R. N. و Kayani I. و Moinuddin S. A. et al. المزايا المحتملة لتعيين الحجم المستهدف المستند إلى FDG PET / CT (18) في تخطيط العلاج الإشعاعي لسرطان الرأس والرقبة // Radiother. أونكول. 2010 المجلد. 97. ص 189 - 193.
17. Deantonio L. ، Beldi D. ، Gambaro G. et al. تصوير FDG-PET / CT للتدريج وتخطيط العلاج الإشعاعي لسرطان الرأس والرقبة // Radiat. أونكول. 2008 المجلد. 3. ص 29.
18. Kodani N. و Yamazaki H. و Tsubokura T. et al. العلاج الإشعاعي بالجسم بالتوضيع التجسيمي لورم الرأس والرقبة: السيطرة على المرض ونتائج المرض // J. Radiat. الدقة. 2011 المجلد. 52- ص 24 - 31.
19. كرم ا. ، ياو م ، هيرون د. وآخرون. مسح للممارسات الحالية من الاتحاد الدولي للعلاج الإشعاعي بالتوضيع التجسيمي للجسم لسرطان الرأس والرقبة // علم الأورام في المستقبل. 2017 المجلد. 13. ص 603-613.
20. Vermorken J. B.، Mesia R.، Rivera F. et al. العلاج الكيميائي البلاتيني بالإضافة إلى سيتوكسيماب في سرطان الرأس والعنق // N. Engl. جيه ميد. 2008 المجلد. 359. ص 1116-1127.
21. هيرون دي إي ، رويجيما جيه سي ، جيبسون إم ك وآخرون. سيتوكسيماب المتزامن مع العلاج الإشعاعي بالتوضيع التجسيمي للجسم لسرطان الخلايا الحرشفية المتكرر في الرأس والرقبة: مؤسسة واحدة مطابقة دراسة الحالات والشواهد // صباحا. جى كلين. أونكول. 2011 المجلد. 34- ص 165 - 172.
22. Vargo J. A. ، Ferris R. L. ، Ohr J. et al. تجربة المرحلة الثانية المرتقبة لإعادة الإشعاع باستخدام العلاج الإشعاعي التجسيمي للجسم بالإضافة إلى سيتوكسيماب في المرضى الذين يعانون من سرطان الخلايا الحرشفية المتكرر في الرأس والرقبة. رديات. أونكول. بيول. فيز. 2015. المجلد. 91. ص 480-488.
يعتبر التشعيع في ممارسة طب الأورام أحد أساليب العلاج الرئيسية. يتم استخدامه لمعظم الأورام الخبيثة ، سواء بالاقتران مع أنواع العلاج الأخرى أو بمفرده. غالبًا ما يوصف العلاج الإشعاعي (RT) ، وهو أحد طرق العلاج الإشعاعي ، لسرطان المعدة. فعاليته وفوائده للمرضى ، والتي تتمثل في زيادة معدلات البقاء على قيد الحياة وتحسين حياة الإنسان ، لا يمكن إنكارها وقد تم تأكيدها منذ فترة طويلة من خلال الممارسة السريرية.
الإشعاع مقابل السرطان
عند إجراء دورة RT ، لتقليل حجم الورم الخبيث ، يتم استخدام إشعاع من النوع المؤين ، والذي يحتوي على مؤشرات طاقة عالية. له تأثير مباشر على الخلايا الطافرة للعضو الداخلي المتأثر فقط. غالبًا ما يتم علاج سرطان المعدة بمثل هذا الإشعاع بالتزامن مع العلاج الكيميائي.
جعلت أحدث تقنيات وتركيبات علم الأورام الحديث من الممكن توسيع مؤشرات هذه الإجراءات. حاليًا ، يتم استخدام عدة أنواع من تشعيع سرطان المعدة في الممارسة السريرية لأمراض الأورام ، ومن بينها الجراحة الإشعاعية التجسيمية التي تعتبر الأكثر شيوعًا. يتيح استخدام هذه التقنية إزالة الأورام الخبيثة دون تدخل جراحي تقليدي ، فقط من خلال تعريضها لشعاع من الإشعاع عالي التردد. في الوقت نفسه ، لا يوجد أي تأثير مؤلم على الأنسجة السليمة.
من بين التركيبات التي يتم فيها استخدام هذا النهج ، فإن الأكثر شيوعًا في ممارسة علم الأورام للتخلص من الأورام الخبيثة من الجهاز الهضمي هي السايبر السكين و True Beam (طريقة خافضة للكسر تدمر الأنسجة غير الطبيعية من أي مكان).
أيضًا ، تُظهر طرق LT التالية أداءً عاليًا جدًا:
- طريقة IGRT مصحوبة بالتحكم البصري. يتم إجراء هذا العلاج الإشعاعي لسرطان المعدة باستخدام التصوير المتكرر أثناء العملية. يتم اختيار طرق التصوير (الأشعة السينية ، التصوير المقطعي بالإصدار البوزيتروني ، الموجات فوق الصوتية ، التصوير بالرنين المغناطيسي ، التصوير المقطعي المحوسب) لكل مريض على حدة. تسمح هذه التقنية بإيصال مستهدف لجرعة محسوبة بدقة من الإشعاع مباشرة إلى الآفة ، حتى لو كانت تؤدي حركات وظيفية.
- 3D-CRT ، أو العلاج الإشعاعي المطابق ثلاثي الأبعاد. يكون تشعيع سرطان المعدة أثناء تنفيذه ضخمًا ، ويكرر شكل الورم تمامًا بسبب العبور الدقيق لـ 3 حزم من الإشعاع المنبعثة من مصادر مختلفة عليه. بشكل فردي ، تكون ضعيفة جدًا وبالتالي لا تؤذي الأنسجة السليمة.
- طريقة IMRT (IMRT) بكثافة معدلة. يمنح هذا التشعيع في سرطان المعدة الأخصائي الفرصة لاختيار الجرعة الأكثر دقة من الإشعاع النظيري للورم ذي الشكل الحجمي ، حيث يمكنه تنظيم وتغيير شدته بشكل مستقل. أيضًا ، بمساعدة IMRT ، يمكن لأطباء الأورام الذين يقومون بهذه الجراحة الإشعاعية تقليل الأضرار التي تلحق بالبنى المهمة بسبب القدرة على تركيز أعلى جرعات من الإشعاع في المناطق غير الطبيعية من الجهاز الهضمي الرئيسي.
يعتبر الأطباء أن العلاج المقطعي هو الخيار الأكثر تقدمًا. يجمع هذا الإجراء بين ميزات وفوائد تقنيات IMRT و IGRT. في الممارسة السريرية الحديثة ، تتيح مجموعة متنوعة من خيارات RT لأخصائيي الأورام الرائدين اختيار الأدوات المثلى لعلاج أنواع معينة من الأورام الخبيثة.
آلية عمل الإشعاع المؤين
يهتم العديد من المرضى الذين تم تشخيص إصابتهم بالأورام في الجهاز الهضمي بمسألة كيفية تدمير الخلايا الطافرة باستخدام هذه الطريقة. ترتبط وفاتهم ارتباطًا مباشرًا بتدمير جزيء الحمض النووي السرطاني للنواة ، ومركب الغشاء والبروتينات الديوكسينوكليوبروتينات ، وهي بروتينات معقدة تحتوي على الكروماتين ، وهي جزء من الكروموسومات. هذا يؤدي إلى اضطرابات في جميع عمليات التمثيل الغذائي (التبادل) في الخلايا المشععة.
من الناحية الشكلية ، تتميز التغيرات التي تحدث في الأنسجة المصابة بثلاث مراحل:
- الضرر الأساسي للأورام.
- بداية عملية الاحتضار
- استبدال الهياكل المدمرة.
لا يبدأ موت الخلايا الطافرة وامتصاصها على الفور ؛ لذلك ، لا يمكن تقييم نتيجة العلاج بالكامل إلا بعد مرور بعض الوقت على اكتمالها.
العلاج الإشعاعي قبل الجراحة لسرطان المعدة
على الرغم من أن التعرض الجراحي يعتبر الطريقة الرئيسية التي تنقذ الشخص من الأورام الخبيثة في الجهاز الهضمي الرئيسي ، إلا أنه فعال للغاية فقط عندما يسبقه مسار RT.
يتيح لك العلاج الإشعاعي لسرطان المعدة ، الذي يتم إجراؤه قبل العملية مباشرة ، تحقيق التأثيرات الإيجابية التالية:
- يقلل من حجم الورم الموجود ؛
- يبطئ إنبات النقائل في الأعضاء القريبة والبعيدة ؛
- يطيل فترة المرض دون تكرار ؛
- يزيد من البقاء على قيد الحياة لمدة خمس سنوات.
لكن الاستخدام الواسع لهذه الطريقة يعوقه المقاومة الإشعاعية العالية (المناعة ضد الإشعاع المؤين) لأورام الجهاز الهضمي الرئيسي والتكيف السريع مع إشعاع الأغشية المخاطية. بالإضافة إلى ذلك ، في الممارسة السريرية لـ RT في بعض المرضى ، لوحظت ظواهر سلبية مثل التأخير في فترة ما قبل الجراحة ، وكذلك زيادة في عدد المضاعفات مع الحد الأدنى من تدمير الورم.
الأهمية!من أجل أن يحقق العلاج الإشعاعي لسرطان المعدة نتائج فعالة حقًا ولا يسبب مشاكل صحية إضافية ، يجب أن يتم التخطيط للمسار المقترح للعلاج بالإشعاع المؤين بحذر شديد. أيضًا ، أثناء العلاج ، يجب على المريض اتباع جميع توصيات الطبيب المعالج بدقة.
عند اختيار دورات التشعيع قبل الجراحة ، يأخذ أطباء الأورام في الاعتبار مهام تقنية العلاج هذه مثل تدمير انتشار الورم (بؤر الخلايا غير الطبيعية) المترجمة على جدران المعدة ، وتدمير الأورام الدقيقة في العقد الليمفاوية المجاورة للأورام الخبيثة. بفضل تحقيق هذه الأهداف ، يحقق المتخصصون بسرعة انخفاضًا في الإمكانات الحيوية للورم وتقليل حجمه ، وكذلك منع تطور ظاهرة مرضية ثانوية مثل سرطان الغدد الليمفاوية في المعدة.
لهذا السبب يولي الأطباء اهتمامًا كبيرًا لاختيار الجرعات اللازمة وحساب إيقاع التعرض للأشعة الإشعاعية. فقط مسار تشعيع سرطان المعدة المختار بشكل صحيح في فترة ما قبل الجراحة سيعطي نتائج واضحة. يمكن رؤية التعيينات العامة التي تنطبق قبل التدخل الجذري في الجدول:
| أيام | الفصيل الأول | الفصيل الثاني | الجرعة اليومية من الإشعاع | |
| الاثنين | 4 | 3 | 7 | هذا إيقاع تقريبي للإشعاع قبل الجراحة. لكل مريض محدد ، يتم وصف جرعات الإشعاع المؤين بشكل فردي. عادة ، الجراحة الجذرية لسرطان المعدة تسبقها جرعة إجمالية من 25-40 جراي. |
| يوم الثلاثاء | 1,5 | 1,5 | 5 | |
| الأربعاء | 1 | 1 | 2,5 | |
| شيرفيرج | 1 | 1 | 2,5 | |
| جمعة | 1 | 1 | 2,5 | |
| السبت | 1 | 1 | 2,5 | |
| الأحد | 1,5 | 1,5 | 5 |
العلاج الإشعاعي بعد الجراحة لسرطان المعدة
يعتبر مجمع LT الذي يتم إجراؤه قبل الجراحة جزءًا إلزاميًا من مجمع العلاج في حالة نمو ورم خبيث في الجهاز الهضمي الرئيسي. في المقابل ، العلاج بعد الجراحة بالإشعاع المؤين عالي التردد ليس مطلوبًا. إنها أقل فعالية وبالتالي لا يصف الخبراء هذه الدورة دائمًا.
المؤشرات الرئيسية لاستخدامه هي:
- زيادة احتمالية الانتشار أثناء العملية (تغلغل الخلايا الطافرة في الليمفاوية ومجرى الدم أثناء الجراحة). من أجل تجنب تكرار المرض لهذا السبب ، يتم وصف المرضى بدورة تشعيع بعد الجراحة للسرير المتبقي بعد الاستئصال ؛
- خطر حدوث عملية ورم خبيث بعد إجراء قدر غير كافٍ من التدخل الجراحي وفقًا لقواعد الإزالة (إزالة التركيز الرئيسي للأنسجة غير الطبيعية مع الأوعية اللمفاوية والعقد الموجودة في المنطقة المجاورة مباشرة).
يتم اختيار مخططات التشعيع في كل حالة من هذه الحالات بشكل فردي لكل مريض بناءً على نتائج الدراسة التشخيصية بعد العملية الجراحية وفعالية علاج ظواهر الورم المتبقية بالأدوية الفعالة. تعتمد فعالية LT بعد العلاج الكيميائي بعد الجراحة لسرطان المعدة بشكل مباشر على مرحلة عملية الأورام ، حيث تم توطين الورم الخبيث في جزء من الجهاز الهضمي وفعالية العملية.
العلاج الإشعاعي أثناء الجراحة لسرطان المعدة
في الممارسة السريرية ، لاحظ أخصائيو الأورام البارزون مشكلة RT مثل استحالة توصيل جرعة عالية من الإشعاع مباشرة إلى الأنسجة التي دمرتها عملية خبيثة دون الإضرار بالبنى الصحية. تم تطوير عدة طرق لحلها. الطريقة الرئيسية هي تقنية IORT - العلاج الإشعاعي أثناء العملية.
يكمن في حقيقة أن الطبيب أثناء التدخل الجراحي يعالج مرة واحدة الأنسجة المصابة بالورم السرطاني بجرعة كبيرة من الإشعاع النظيري عالي التردد.
على الرغم من أن طريقة العلاج هذه عمليًا بدون مضاعفات ، إلا أن لها عددًا من العيوب المحددة:
- يتطلب استخدامه وضع معدات إضافية في غرفة العمليات ؛
- عند استخدام هذه الطريقة ، من المستحيل تجنب الآثار الضارة على الهياكل الصحية في المنطقة المجاورة مباشرة للتكوين الخبيث لجرعة عالية من الإشعاع ؛
- يتأثر نجاح الإجراء بالوجود الإجباري في وحدة التشغيل لأخصائي أشعة الأورام - وهو أخصائي عالي التخصص يشارك في العلاج الإشعاعي ؛
- أثناء تعريض المريض لجرعة عالية من الإشعاع ، يجب أن يرتدي جميع العاملين في المجال الطبي المشاركين في العملية ملابس واقية تمنع اختراق الأشعة عالية التردد.
لكن أوجه القصور في تقنية IORT لا تشكل عقبة أمام استخدام هذه التقنية للأغراض العلاجية ، حيث إن فعاليتها ووجود كفاءة عالية لدى غالبية المرضى تجعل هذه الطريقة المبتكرة للتعرض للإشعاع في الأورام الخبيثة في الجهاز الهضمي الرئيسي أمرًا لا غنى عنه. رغم أنه من الجدير بالذكر أنه بالرغم من ذلك ، فإن العلاج الإشعاعي أثناء جراحة سرطان المعدة غير متوفر بعد لمعظم المؤسسات الطبية.
هذا يرجع إلى حقيقة أنه لا يوجد في الوقت الحاضر إنتاج تسلسلي للمسرعات الخطية ، وهي أجهزة متخصصة لإجراء IORT. بالإضافة إلى ذلك ، يتأثر عدم إمكانية الوصول إلى التطبيق الشامل لهذه التقنية عالية الفعالية إلى حد كبير بالتكاليف المادية الكبيرة اللازمة للاستخدام المنتظم لهذه التقنية العلاجية في بروتوكولات العلاج ، وكذلك بالبعد عن وحدات التشغيل لوحدات وحدة التحكم والأودية.
هل العلاج الإشعاعي جيد لسرطان المعدة؟
يستخدم RT لتدمير هياكل الأنسجة غير الطبيعية ، ويهدف إلى تدمير الخلايا المكونة لها. ترجع قدرة الأشعة الإشعاعية على تدمير الخلايا الطافرة إلى حقيقة أن الإشعاع المؤين ، عند تفاعله مع السائل الخلالي ، يؤدي إلى تحللها إلى جذور حرة ، والتي تمزق الإلكترونات من الجسيمات الدقيقة غير الطبيعية ، والبيروكسيد. نتيجة لذلك ، يتم تدمير الخلايا غير الطبيعية بسرعة أثناء التشعيع. مثل هذا التأثير للإشعاع على الأورام الخبيثة ممكن في أي مرحلة من مراحل سرطان المعدة ، لذا فإن فوائد العلاج الإشعاعي في هذه الحالة المرضية واضحة.
تعتبر هذه الطريقة فعالة للغاية في معظم الأورام الخبيثة ، ولكن في حالة أمراض الجهاز الهضمي الرئيسي ، لا يتم استخدامها دائمًا. هناك تفسير بسيط لذلك. عندما يتم علاج سرطان المعدة بالإشعاع المؤين ، فإن فوائد هذا التأثير العلاجي غالبًا ما تكون أقل بكثير من الضرر الذي يلحق بجسم الإنسان. هذا بسبب مخاطر الأضرار التي لحقت بالجوار اعضاء داخليةوقدرة الغشاء المخاطي في المعدة على التعود على الأشعة الإشعاعية ، ولهذا يجب زيادة جرعتها. هذا هو السبب في أن قرار وصف دورة LT يتخذ من قبل أخصائي بعد تقييم جميع الإيجابيات والسلبيات بعناية.
كيف ومتى يستخدم العلاج الإشعاعي لسرطان المعدة؟
في حالة وجود ورم خبيث في معدة الإنسان ، غالبًا ما يستخدم LT للأغراض الملطفة ، لتقليل مظاهر الأعراض السلبية. عادة ، يتم تعيين الإشعاع من هذا النوع إذا كان الشخص مصابًا بسرطان غدي في المعدة.
استخدام هذه التقنية ، على الرغم من أنها لا تقضي على هذا النوع من الأورام ، فهي فعالة في القضاء على متلازمة الألم الحاد وغيرها من المظاهر السلبية والخطيرة للمرض. يؤدي هذا إلى تحسن كبير في نوعية حياة المريض.
أيضًا ، استخدام LT مطلوب في الحالات التالية:
- قبل الجراحة. يساعد مسار الإشعاع المؤين الموصوف بشكل صحيح على تقليل حجم الورم ، مما يسهل العملية ؛
- بعد الجراحه. هنا ، يرجع تطبيق هذه الطريقة إلى الحاجة إلى تدمير الخلايا غير الطبيعية المتبقية ؛
- لوقف عملية تطور تكرار المرض.
الأهمية!في كل حالة محددة ، من الضروري اختيار دورة فردية من LT بواسطة متخصص. لهذا ، تؤخذ بعين الاعتبار مؤشرات مثل الفئة العمرية والصحة العامة للمريض ، ووجود أعراض سلبية ، وكذلك نوع ومرحلة تطور الورم الخبيث.
التحضير للعلاج الإشعاعي
عادة ، قبل البدء في دورة التعرض للأورام الخبيثة بالإشعاع ، من الضروري تحضير المريض لها. تتكون المرحلة التحضيرية من عدة جوانب مهمة إلى حد ما. أساسه هو تصحيح التغذية. قبل 10 أيام من بدء الإجراءات ، يجب أن تبدأ في اتباع نظام غذائي يُحظر فيه تمامًا الأطعمة المخللة والحارة والمدخنة والدسمة. استهلاك المشروبات الكحولية ممنوع منعا باتا.
أيضًا ، قبل أسبوع من العلاج الإشعاعي ، يجب على الشخص القيام بتمارين التنفس ، وزيادة وقت النوم وإجراء عملية تطهير الفم. تشمل الأنشطة التحضيرية أيضًا اكتساب بعض الأشياء الضرورية أثناء العلاج.
يمكنك رؤية قائمة بها في الجدول:
| ما الذي سيكون مطلوبًا أثناء دورة LT؟ | لماذا هو ضروري؟ |
| وجود ملابس قطنية مع حد أدنى من اللحامات | طوال فترة التعرض للإشعاع المؤين على الجسم ، من الضروري ارتداء مثل هذه الملابس ، لأن هذا سيضمن أقل صدمة للجلد المشع. |
| اكتساب الأعشاب ذات التأثير المطهر والمقبض - لحاء البلوط ، والمريمية ، والبابونج | يساعد الشطف ست مرات يوميًا باستخدام مغلي هذه النباتات من الفم والحلق على تقليل الآثار السلبية للإشعاع. |
| استبدال فرشاة الأسنان ومعجون الأسنان | لا يمكن ضمان حماية تجويف الفم من التلف المحتمل إلا عن طريق تنظيف الأسنان بعناية باستخدام فرشاة ناعمة إلى حد ما ذات حجم صغير ومعاجين هلامية تحتوي على الفلورايد. |
تتضمن عملية تحضير المريض للعلاج الإشعاعي أيضًا بعض التدابير التشخيصية. إنها ضرورية لتوضيح حجم وموقع الورم. ستساعد نتائج الدراسة أخصائي الأشعة في تحديد الجرعة المثلى من الإشعاع لكل مريض على حدة وزاوية الإشعاع عالي التردد.
متى يتم منع العلاج الإشعاعي للسرطان؟
RT ، خاصة عندما يقترن بعلاج قوي الأدويةقادرة على التسبب في ضرر لا يمكن إصلاحه للجسم. هذه السمة السلبية لها هي العامل الرئيسي الذي يؤخذ في الاعتبار أثناء المواعيد. عادةً ما يكون عدد المرضى المقبولين في هذا النوع من العلاج محدودًا ببعض المؤشرات.
الموانع الرئيسية لإجراء جلسات العلاج باستخدام هذه الطريقة هي:
- الأمراض الشديدة اللا تعويضية (الأمراض المزمنة التي تحدث بشكل حاد مع فترات متكررة من التفاقم) في الكلى والكبد والجهاز التنفسي والقلب والأوعية الدموية ؛
- دنف السرطان - مشاكل في عمل معظم الأعضاء الداخلية والإرهاق الشديد الناجم عن التطور التدريجي للورم الخبيث ؛
- شكل حاد أو مزمن من مرض الإشعاع الناتج عن تلقي المريض جرعة زائدة من العزل لبعض الوقت ؛
- أمراض عقلية؛
- مرض السل.
الأهمية!نظرًا لموانع استخدام طريقة العلاج هذه ، قبل تعيينها ، من الضروري الخضوع ليس فقط لتشخيص متخصص يكشف عن شكل وحجم الورم النامي ، ولكن أيضًا استشارة المتخصصين المشاركين في علاج أمراض أخرى من الأعضاء الداخلية ، وكذلك الجهاز العصبي والدورة الدموية.
المضاعفات بعد العلاج الإشعاعي لسرطان المعدة
ترتبط الآثار الجانبية للتعرض للإشعاع المؤين ارتباطًا مباشرًا بعوامل مثل نوعه ، وعمق الاختراق في هياكل الأنسجة ، وردود الفعل الفردية لجسم الإنسان. كلما طالت فترة التعرض للإشعاع وكلما زاد تواتر الأشعة المستخدمة له ، كان رد فعل المريض أكثر وضوحًا. في أغلب الأحيان ، يتم ملاحظة المضاعفات بعد العلاج الإشعاعي لدى مرضى السرطان الذين تم وصفهم لفترة طويلة من العلاج. لكل شخص رد فعل جسده تجاه تأثيرات الأشعة الإشعاعية. بالنسبة للبعض ، قد يكون الأمر واضحًا تمامًا ، بينما لن يلاحظ البعض الآخر ظهور الآثار الجانبية.
من بين المضاعفات الرئيسية التي يمكن أن تحدث أثناء العلاج الإشعاعي ، يميز الخبراء ما يلي:
- ظهور تورم ووجع واضح في موقع التعرض ؛
- فقدان القوة الذي لا يمكن تفسيره والشعور المستمر بالتعب ؛
- ردود الفعل المرضية من الأغشية المخاطية ، على سبيل المثال ، تطور التهاب الفم أو تكوين الأورام الحليمية ؛
- السعال المستمر وضيق التنفس.
- الشعور المستمر بالعطش والجوع.
- تلف في موقع تشعيع الجلد (ظهور حروق عليها ، على غرار الشمس) ؛
- تساقط الشعر الشديد.
مضاعفات LT ليست دائما شديدة. بعض الأشخاص الذين يخضعون لمثل هذه الدورات العلاجية نادراً ما يلاحظونها. أيضًا ، لا يمكن اعتبار وقت ظهور النتائج السلبية واضحًا. في بعض الحالات تظهر الأعراض الجانبية مباشرة بعد الجلسة ، بينما في حالات أخرى قد تظهر فقط بعد خروج المريض من المستشفى.
السكين السيبراني لسرطان المعدة: موانع الاستعمال والتحضير
يمكّن هذا النظام المتخصصين من إزالة الأورام الخبيثة والنقائل حتى في الأماكن التي يصعب الوصول إليها. لمثل هذا العلاج ، يتم استخدام الأشعة الإشعاعية. إن دقة الفوتونات المنبعثة من الجهاز التي تصطدم بالمنطقة المصابة عالية جدًا ، مما يجعل من الممكن "حرق" الورم نفسه مباشرةً ، دون تعريض الهياكل الصحية في المنطقة المجاورة مباشرة للتلف الإشعاعي.
إذا قرر أخصائي الأورام استخدام السايبر نايف في علاج سرطان المعدة ، فإن بعض الإجراءات ضرورية لجعل الإجراء أكثر فعالية وأمانًا تمامًا للشخص. يمكن رؤية المراحل الرئيسية للتحضير لدورة العلاج في الجدول أدناه:
| مراحل التحضير | تقنية |
| وضع التسميات | يتم وضع غرسات الذهب في الورم أو بالقرب منه لتوجيه الاتجاه الدقيق لشعاع الإشعاع. يتم إجراء العملية في العيادة الخارجية وبعد اكتمالها يُسمح للشخص بالعودة إلى المنزل. |
| خلق منع الحركة | يصنع كل مريض بدلة خاصة مصنوعة من البلاستيك ، والتي يجب أن تكون مريحة للغاية ، لأن الشخص سيضطر إلى البقاء فيها لفترة طويلة من الزمن. من الضروري استبعاد الحركات العشوائية |
| وضع خطة العلاج | في هذه المرحلة ، يتم إجراء إجراءات التشخيص غير المؤلمة CT أو MRI أو PET. بمساعدتهم ، يتم تحديد موقع الورم وشكله وحجمه. |
| اعداد الآلة | بناءً على الصور التي تم الحصول عليها في المرحلة السابقة ، تمت برمجة Cyberknife. تتمثل عملية تحضير النظام في وضع معلومات حول الورم فيه: الموقع والعلاقة مع الهياكل الصحية والشكل والحجم. بالإضافة إلى ذلك ، يقوم الاختصاصي بحساب جرعة الإشعاع المثلى. |
وتجدر الإشارة إلى أن استخدام السايبر نايف لسرطان المعدة لا يُستخدم دائمًا. هذا الإجراء طفيف التوغل ، وهو فعال للغاية ، له موانع معينة.
وتشمل هذه:
- أورام واسعة النطاق في مرحلة الانحدار المستمر والتي يمكن أن تؤدي إلى تنخر الرادي الذي يشكل تهديدًا مباشرًا لحياة الإنسان ؛
- الأورام الكبيرة ، نتيجة الاحتراق الذي قد يتشكل منه الناسور.
هذه الموانع مطلقة ، أي أن وجودها يجعل العملية باستخدام نظام CyberKnife غير مقبولة بشكل قاطع. يشير المتخصصون أيضًا إلى النسبيين ، والتي ، في حالة الحاجة الحيوية لاستخدام هذا النوع من العلاج ، يمكن إلغاؤها. تشمل موانع الاستعمال هذه النقائل واسعة النطاق في الجهاز الهضمي الرئيسي ، وتفاقم تاريخ من الأمراض ، والاضطرابات العقلية ، وفحوصات الدم السيئة للشخص وحالته العامة الشديدة.
Cyberknife: عملية علاج سرطان المعدة
طريقة التطبيق في تدابير علاجيةمن هذا الجهاز شديد الحساسية يعتمد على قدرة الإشعاع على التسبب بسرعة في تدمير الهياكل الخلوية غير الطبيعية. تأثير الإجراء مشابه لتأثير المبضع ، فقط بدون افتراض إصابة الجلد والأنسجة العضلية.
المراحل الرئيسية للعلاج باستخدام نظام السايبر نايف لسرطان المعدة:
- يتم إعطاء مريض السرطان أشعة سينية ضرورية للتوجيه في الموضع الصحيح للمسرع الخطي ؛
- يرتدي المريض ملابس قطنية مريحة بدون طبقات لمنع الإصابة المحتملة أثناء تشعيع الجلد ؛
- يتم وضع قناع خاص على رأس الشخص للحماية من الأشعة الإشعاعية ؛
- يوضع المريض على الطاولة ويتم توصيل الجهاز ، حيث يتحرك المناور حول جسده ، ويتوقف بشكل دوري عند نقاط محددة مسبقًا للإشعاع المباشر.
تدوم جلسة LT الواحدة مع CyberKnife من نصف ساعة إلى ساعتين. بعد يوم واحد من الإجراء ، يعود الشخص إلى العيادة لإجراء قياسات التحكم. إنها تسمح لك بمعرفة فعالية العلاج الذي يتم إجراؤه. للتحكم الأكثر دقة ، يتم استخدام طرق التشخيص مثل التصوير بالرنين المغناطيسي والتصوير المقطعي المحوسب.
باستخدام نظام cyberknife لعلاج سرطان المعدة ، لا يمكن للأخصائي المتمرس تحقيق الكفاءة العالية للإجراء فحسب ، بل يوفر أيضًا للمريض راحة عالية أثناء العملية. مزايا الإجراءات العلاجية بمساعدة هذا الجهاز هي للإنسان في حالة عدم وجود الآلام والشقوق التي تترك ندبات. أيضًا ، يتم إجراء هذا العلاج بدون تخدير ، حيث يتعافى المريض خارج المستشفى في وقت قصير ويمكنه العودة بسرعة إلى أسلوب حياته المعتاد.
عواقب
على الرغم من أن العلاج الإشعاعي يعتبر أحد أكثر الطرق فعالية للتأثير على الأورام السرطانية ، إلا أنه لا يزال يشكل خطرًا متزايدًا لبعض المرضى. إنه متصل بـ العواقب المحتملةهذا النوع من العلاج. ترتبط بالتأثيرات السلبية للإشعاع على الأنسجة السليمة الموجودة في المنطقة المجاورة مباشرة للأورام الخبيثة.
يلاحظ الخبراء ما يلي العواقب العامةالعلاج الإشعاعي:
- التأثير المرضي على الدم. يرتبط بإمكانية التعرض للإشعاع المشع لإعاقة وظيفة إنتاج خلايا الدم في نخاع العظام. والنتيجة هي تطور قلة العدلات أو فقر الدم.
- زيادة التعب والإرهاق المستمر. تظهر بسبب حقيقة أن جسم الإنسان يوجه قواه الرئيسية لمكافحة الضرر الناجم عن التعرض لل LT على الخلايا السليمة.
عادة ما تزداد هذه المظاهر السلبية في سياق جلسات LT. من أجل تقليل تأثيرها السلبي على الجسم ، يوصي الخبراء خلال فترة التشعيع بالخروج في كثير من الأحيان وتناول الطعام بشكل صحيح. يتم تقديم جميع التوصيات الفردية التي تساعد على التعامل مع العواقب الوخيمة للتدابير العلاجية باستخدام إشعاع النظائر المشعة لكل مريض من قبل الطبيب المعالج عند وصف الدورة.
الجراحة الإشعاعية لسرطان المعدة
هذا الإجراء ، الذي يتم تنفيذه بمساعدة الإشعاع النظيري ، هو أحد مكونات LT. ميزته الرئيسية هي اتجاه شعاع النظائر مباشرة على الورم نفسه ، متجاوزًا أنسجة العضلات. تُستخدم الجراحة الإشعاعية لسرطان المعدة أو أثناء الجراحة التقليدية لإزالة الورم ، أو يتم تسليم الفوتونات إليها باستخدام كبسولات أو قثاطير أو إبر مزروعة بشكل دائم ومتصلة مؤقتًا. بفضل هذه الطريقة ، يتم ضمان مثل هذا التأثير الدقيق للنظائر على الأنسجة المتأثرة بعملية غير طبيعية ، والتي لا تسبب أبدًا أي مضاعفات وآثار جانبية.
في علم الأورام السريري ، هناك عدد من المؤشرات لهذا النوع من التعرض للإشعاع:
- موقع الورم في مكان يصعب الوصول إليه ؛
- رفض المريض إجراء التدخل الجراحي التقليدي ؛
- وجود النقائل في منطقة الجهاز الهضمي الرئيسي.
طريقة هذا التأثير على النحو التالي. في الوقت الذي يتم فيه فتح تجويف البطن أثناء إجراء عملية جذرية ، يتم توصيل أنبوب مطاطي بقطر أدنى إلى جذع العضو الهضمي الرئيسي ، على ارتفاع سنتيمتر واحد فوق المفاغرة ، مع خيوط جراحية في القناة الهضمية. يتم وضع الأنبوب الثاني نفسه في نسيج المنطقة خلف الصفاق. وهي مصممة لأداء دورين - أولاً ، تعمل بمثابة تصريف بعد الجراحة ، وثانيًا ، يتم تغذية الكوبالت المشع من خلالها ، مما يؤدي إلى إتلاف الحمض النووي للخلايا المصابة ، مما يتسبب في موتها.
عيوب الطريقة
هذا الإجراء فعال للغاية ولا يسبب أبدًا آثارًا جانبية ، ولكن لا يزال الخبراء يلاحظون بعض المضاعفات المبكرة للجراحة الإشعاعية لسرطان المعدة:
- ظهور ضعف عام غير محفز والتعب والصداع الحاد.
- تورم وتهيج الجلد مع تقشير وحكة وتصبغ الجلد عند النقطة التي يتم فيها جلب الأنبوب إلى السطح ؛
- الشعور المستمر بالغثيان ، يتخللها القيء من وقت لآخر ؛
- نوبات عرضية
- اضطرابات البراز.
بعد تطبيق هذه الطريقة ، هناك أيضًا عواقب طويلة المدى لجراحة الرود. وتشمل هذه التغيرات السلبية في الأعضاء الداخلية (الكلى والرئتين والمستقيم والدماغ والحبل الشوكي). لا يمكن تجنبها إلا إذا تم وصف وتنفيذ العلاج المناسب على النحو الأمثل ، والذي لا يُسمح فيه بالأخطاء ، سواء من جانب الطبيب والمريض. يجب أن تدرك أيضًا أن كلا من العلاج الكيميائي والعلاج الإشعاعي ليسا طريقتين مستقلتين. هم ، كقاعدة عامة ، علاج إضافي يتم إجراؤه بالتزامن مع التعرض الجراحي.
فيديو إعلامي
اليوم ، يتم علاج حوالي نصف مرضى السرطان بالعلاج الإشعاعي. يستخدم هذا العلاج ، الذي تم تطويره في مطلع القرن العشرين ، قوة الإشعاع لقتل الخلايا السرطانية بينما يحاول تجنب إيذاء الأنسجة السليمة المجاورة.
لقد قطع العلاج الإشعاعي للسرطان في إسرائيل شوطًا طويلاً منذ بدايته. سمحت التطورات الحديثة للأطباء بتطوير طريقة أكثر أمانًا وأسرع تسمى العلاج الإشعاعي ناقص التجزئة ، والتي تساعد الأطباء على خفض الدورات الإشعاعية بمقدار النصف تقريبًا ، مما يقلل بشكل كبير من إجمالي كمية العلاج الإشعاعي التي يحتاجها المريض. يمكن أن يؤدي تقليل عدد جلسات العلاج الإشعاعي إلى تحسين نوعية حياة المرضى - حيث يمكن أن تؤدي العلاجات الأقل إلى تقليل الآثار الجانبية غير السارة مثل تهيج الجلد وفقدان الشهية والغثيان والإرهاق التي غالبًا ما ترتبط بعلاجات السرطان. كما يعني أيضًا عددًا أقل من الرحلات إلى مركز السرطان.
إذا كنت مهتمًا بتكلفة علاج السرطان في إسرائيل ، وكنت مهتمًا بالمبلغ الحقيقي ، وليس حيلة تسويقية لخفض الأسعار ، فيرجى الاتصال بنا بأي طريقة مناسبة. سنتواصل معك على الفور للإجابة على الأسئلة التي نتلقاها.
تعرف على تكلفة العلاج
في بعض الحالات ، قد يكون إعطاء جرعة أعلى في جلسات أقل علاجًا أكثر فعالية للسرطان.
بينما يقدم العلاج الإشعاعي التقليدي كمية صغيرة من الإشعاع للمريض لمدة تسعة أسابيع ، فإن العلاج الإشعاعي ناقص التجزئة يقدم جرعات كبيرة أو كسورًا من الإشعاع ، غالبًا في حوالي خمسة أسابيع ، وأحيانًا في أقل من بضعة أيام. العلاج الإشعاعي التجسيمي (SBRT) ، وهو شكل دقيق وعالي الجرعة من العلاج الإشعاعي ناقص التجزئة ، يسمح للأطباء بعلاج السرطان في أقل من علاج واحد إلى خمسة.
تعتبر العلاجات الإشعاعية السريعة فعالة جزئيًا لأن التكنولوجيا المتقدمة تساعد الفيزيائيين على حساب الجرعة الصحيحة من الإشعاع وتحديد موضع المريض بدقة لاستقباله بحيث تستهدف حزم الإشعاع الأورام فقط. الهدف هو ترك أكبر عدد ممكن من الخلايا المحيطة السليمة بمنأى عن الإشعاع.
تتحسن القدرة على الحفاظ على جودة حياة المريض مع كل تقدم في تكنولوجيا الإشعاع.
تشمل التطورات برامج الحوسبة عالية التقنية ، والتكنولوجيا التي تساعد على حماية أجزاء الجسم القريبة من الإشعاع ، والمسح رباعي الأبعاد لتخطيط العلاج. هذه القدرة أفضل مما كانت عليه قبل خمس سنوات وقفزة كبيرة تتجاوز ما كان متاحًا قبل 10 سنوات.
ومع ذلك ، فإن العلاج الإشعاعي السريع ليس خيارًا لجميع المرضى أو حتى جميع أنواع السرطان. يصف أطباء الأورام بالإشعاع نقص التجزؤ للمرضى الذين يخضعون لعلاجات سرطان البروستاتا والجهاز الهضمي والرئة والثدي.
علاج سرطان البروستاتا في إسرائيل
وقت العلاج: العلاج القياسي لسرطان البروستاتا في إسرائيل هو عبارة عن مسار من 44 جلسة علاجية على مدى تسعة أسابيع. مع العلاج الإشعاعي ناقص التجزئة ، يتم وصف خمسة علاجات على مدار أسبوعين للمرضى.
تطورات جديدة: العلاج الإشعاعي علاج شائع لسرطان البروستاتا. ومع ذلك ، يمكن أن يتسبب الإشعاع في تلف المستقيم القريب من غدة البروستاتا. حماية المستقيم أمر مهم ؛ في حالة تلفه ، قد يعاني الشخص من سلس البول.
لقد فتحت التقنيات الحديثة الباب أمام علاج آمن وسريع لسرطان البروستاتا. واحد منهم ، SpaceOAR ، هو أساسًا فاصل هلامي يساعد على إبقاء المستقيم بعيدًا عن البروستاتا أثناء العلاج الإشعاعي. هذا يخلق طبقة أخرى من الأمان عن طريق وضع السوائل بين البروستاتا والمستقيم ، مما يحمي المستقيم بشكل فعال من جرعات عالية جدًا من الإشعاع.
يستخدم الأطباء الإسرائيليون أيضًا التكنولوجيا المتقدمة لتتبع الحركة الطبيعية للبروستاتا أثناء العلاج الإشعاعي. هذا نظام تتبع رباعي الأبعاد يستخدم مرسلات مستجيبات صغيرة الحجم يتم زرعها في البروستاتا بواسطة طبيب المسالك البولية أثناء إجراء سريع للمرضى الخارجيين. إذا تحركت البروستاتا أثناء العلاج ، فإن أجهزة الإرسال والاستقبال "تطلق جرس الإنذار" لتنبيه فريق علاج الأورام بالإشعاع. يتم إيقاف العلاج تلقائيًا حتى يقوم الفنيون بإجراء التعديلات اللازمة لحماية المناطق المحيطة بالبروستاتا ، وخاصة المستقيم والمستقيم مثانة.
يتيح الجمع بين تقنية SpaceOAR المتقدمة وتتبع الترددات اللاسلكية إجراء SBRT عالي الأمان للبروستاتا.
احصل على برنامج علاجي
لمن هو: العلاج الإشعاعي السريع (العلاج الإشعاعي ناقص الكسر) مناسب لمعظم المرضى الذين يخضعون لعلاج سرطان البروستاتا في إسرائيل. الاستثناءات هي الرجال الذين يعانون من أعراض بولية شديدة (العلاج الأسرع له آثار جانبية بولية قصيرة المدى أعلى قليلاً ، مثل الالتهاب وانسداد المثانة). بالإضافة إلى ذلك ، لا تُستخدم هذه الطريقة للرجال الذين يحتاجون إلى علاج الحرمان من الأندروجين ( العلاج بالهرمونات، الذي يثبط هرمون التستوستيرون) ، أو الذين يحتاجون إلى الإشعاع للغدد الليمفاوية الإقليمية.
علاج سرطان الجهاز الهضمي في إسرائيل
وقت العلاج: يحدث سرطان الجهاز الهضمي في المريء والمعدة والجهاز الصفراوي والبنكرياس ، الأمعاء الدقيقةوالقولون والمستقيم والشرج. عند الخضوع لعلاج سرطان المعدة في إسرائيل أو علاج سرطان الأمعاء في إسرائيل مع العلاج الإشعاعي القياسي ، يتلقى المرضى العلاج خمسة أيام في الأسبوع لمدة ستة أسابيع تقريبًا. ومع ذلك ، فإن SBRT يقلل عدد العلاجات إلى خمسة ، جرعة عالية. هذا النهج الأسرع لعلاج سرطان الجهاز الهضمي في إسرائيل يلغي أيضًا الحاجة إلى العلاج الكيميائي المتزامن.
التطورات الجديدة: استخدام التصوير المقطعي المحوسب بالسكين رباعي الأبعاد لتخطيط العلاج - بشكل أساسي هو مقطع فيديو يوضح حركة الورم أثناء تنفس المريض ، تسمح هذه الأشعة المقطعية ذات التخطيط رباعي الأبعاد بتركيز مجال الإشعاع على المنطقة الدقيقة التي تشغلها الأورام أثناء الدورة التنفسية. كما يتم استخدام التقنيات للحد من حركة الورم من التنفس وتتبع حركة الأورام أثناء العلاج.
مناسب لـ: للمرضى الذين لا يتلقون العلاج الكيميائي ، SBRT هو خيار لعلاج سرطان الجهاز الهضمي في إسرائيل في الحالات التي لا يوجد فيها سرطان البنكرياس أو يمكن إزالته جزئيًا أثناء الجراحة ، أو للمرضى الذين لا يمكنهم إجراء عملية جراحية لأسباب أخرى. اسباب طبية. وهو أيضًا خيار للمرضى الذين يعانون من تورم متكرر في نفس المنطقة بعد الجراحة. يستخدم SBRT أيضًا في المرضى الذين يعانون من أورام الكبد الأولية (مثل سرطان الخلايا الكبدية وسرطان الأوعية الصفراوية) وفي المرضى الذين يعانون من عدد محدود من النقائل الكبدية.
تقدم للعلاج
علاج سرطان الرئة في إسرائيل
وقت العلاج: يوم مرحلة مبكرةيستغرق علاج سرطان الرئة في إسرائيل بالعلاج الإشعاعي القياسي حوالي سبعة أسابيع من الإشعاع. يمكن تقليل هذا الوقت إلى ثلاثة إلى خمسة علاجات على مدار أسبوعين ، ويمكن علاج المرضى المصابين بسرطان متقدم لا ينتقل في غضون أربعة أسابيع تقريبًا.
تطورات جديدة: يتيح استخدام تقنية التصوير عالي الدقة استهدافًا أكثر دقة للإشعاع للأورام ، مما يسمح بإيصال جرعات أعلى من الإشعاع في عدد أقصر من الدورات.
لمن هو: مرضى السرطان ، محدودة منطقة الصدرقد يكون الأشخاص الذين لن يأخذوا علاجًا كيميائيًا مرشحين للعلاج الإشعاعي ناقص التجزئة.
علاج سرطان الثدي
وقت العلاج: بالنسبة لسرطان الثدي في مراحله المبكرة ، يتكون العلاج القياسي في إسرائيل إما من استئصال الثدي أو الحفاظ على الثدي (المعروف أيضًا باسم جراحة الحفاظ على الثدي أو استئصال الكتلة الورمية) متبوعًا بخمسة إلى سبعة أسابيع من إشعاع الثدي. يوصى الآن بالعلاج الإشعاعي ناقص التجزئة لبعض المرضى. الآثار الجانبية للدورة العلاجية الأقصر تكافئ أيضًا إن لم تكن أفضل من العلاج القياسي.
سجل لتلقي العلاج
مسار العلاج الإشعاعي المجزأ لسرطان الثدي هو إعطاء جرعة يومية أكبر قليلاً من الإشعاع خمسة أيام في الأسبوع ، مع حوالي 15 جزءًا لمدة أربعة أسابيع بدلاً من 33 جزءًا لمدة سبعة أسابيع. في نهاية المطاف ، فإن الجرعة الإجمالية المتلقاة مع العلاج بنقص التجزئة متساوية وتنتج نتائج وآثار جانبية مماثلة.
التطورات الجديدة: تقنية تسمى Deep Inspiration Breath-Hold (DIBH) تجعل العلاج الإشعاعي للصدر أكثر أمانًا لمرضى سرطان الجانب الأيسر من الثدي عن طريق الحد من تأثير الإشعاع على القلب. عندما يتم توجيه الإشعاع إلى الصدر أو جدار الصدر بالكامل ، فإن الحزمة الإشعاعية تدمر كل الأنسجة التي تلامسها. في مرضى سرطان الثدي من الجانب الأيسر ، تتعرض أجزاء من القلب والرئتين الواقعة تحت الصدر أحيانًا لشعاع الإشعاع. مع DIBH ، يتم تسليم الإشعاع فقط عندما يأخذ المريض نفسًا عميقًا وفي وضع دقيق يوسع الصدر ويحرك القلب بأمان خارج الحزمة الإشعاعية.
من هو: تشعيع الثدي غير المجزأ هو العلاج الموصى به لمجموعة مختارة من مرضى سرطان الثدي المبكر.
مع العلاج الإشعاعي ناقص التجزئة ، أصبح علاج السرطان أسرع وأسهل لمرضى سرطان البروستاتا والجهاز الهضمي والرئة والثدي. وتجري حاليًا التجارب السريرية لتحديد ما إذا كانت أوقات العلاج الأسرع ستعالج بفعالية أنواعًا أخرى من السرطان.
إس آي تكاتشيف ، إس في ميدفيديف ، دي إس رومانوف ، بي في بوليتشكين ، تي في يوريفا ، آر إيه جوتنيك ، آي بي يازجونوفيتش ، إيه في بيردنيك ، ويو ب.
ظهور التطورات التقنية المبتكرة: التخطيط ثلاثي الأبعاد ، واستخدام ميزاء متعدد الأوراق ، على غرار كثافة العلاج الإشعاعي ، وطرق التثبيت الأكثر تقدمًا ، زاد بشكل كبير من إمكانية تلخيص جرعة التأين بدقة وتصعيدها. الإشعاع إلى الحجم المحدد. لقد غيّر هذا فهم دور العلاج الإشعاعي في علاج نقائل الكبد. تشير بيانات المؤلفين الأجانب إلى إمكانية تحقيق 95٪ سيطرة موضعية بعد عام واحد من العلاج الإشعاعي التجسيمي ، 92٪ - بعد عامين (و 100٪ للأورام التي يقل حجمها عن 3 سم) مع تطور الضرر الإشعاعي للثالث وأعلى درجة في 2٪ فقط من الحالات. في عام 2011 ، بعد إعادة التجهيز التقني لمركز أبحاث السرطان الروسي التابع لمعهد الميزانية الفيدرالية التابع للدولة والذي سمي على اسم إن. بلوخين من الأكاديمية الروسية للعلوم الطبية ، في الممارسة السريرية لعلاج المرضى الذين يعانون من نقائل الكبد ، بدأ تقديم تقنية الجراحة الإشعاعية التجسيمية المحلية (SBRS). تسمح لك هذه التقنية بتكوين جرعة عالية من الإشعاع المؤين محليًا في عقدة ورم منتشر وتسبب تدمير الورم. أدى هذا الاتجاه الواعد في علاج سرطان الكبد النقيلي إلى زيادة كبيرة في إمكانيات العلاج المشترك. يقدم المقال مراجعة للأدبيات المتعلقة بعلاج النقائل الكبدية ، كما ننشر نتائج استخدام الجراحة الإشعاعية التجسيمية في خمسة وثلاثين مريضًا يعانون من نقائل الكبد وحالة سريرية للاستخدام الناجح لهذه التقنية في مريض متفاقم جسديًا .
الكلمات المفتاحية: نقائل الكبد ، الجراحة الإشعاعية التجسيمية ، التحكم الموضعي.
معلومات التواصل:
S. N. N. Blokhin ، RAMS ، موسكو. للمراسلات رومانوف دينيس سيرجيفيتش ، [بريد إلكتروني محمي]
مقدمة
أثناء تشريح الجثة ، تم العثور على بؤر النقائل في الكبد في 30٪ من المرضى المصابين بأمراض الأورام. لعلاج المرضى الذين يعانون من نقائل الكبد المتعددة (أكثر من ثلاث بؤر) ، يفضل العلاج الدوائي النظامي و / أو الإقليمي. في المرضى الذين يعانون من تلف الكبد المحدود ، من الممكن استخدام طرق العلاج المحلية ، مثل: الاستئصال الجراحي ، الاجتثاث الحراري بالترددات الراديوية ، الانصمام الكيميائي ، الانصمام الإشعاعي ، التدمير بالتبريد ، إعطاء الإيثانول ،
التخثر بالميكروويف ، التدمير الحراري بالليزر ، التحليل الكهربائي للانبثاث. كل من هذه الأساليب لها مزاياها وعيوبها ، ولكن يمكن استخدام العلاج الإشعاعي التجسيمي فقط إذا كانت هناك موانع لاستخدام الطرق المذكورة أعلاه.
لفترة طويلة ، كان العلاج الإشعاعي يعتبر تقنية غير واعدة لعلاج نقائل الكبد. لم يثبت استخدام مثل هذه التقنية ، مثل التشعيع الكلي للكبد ، فعاليته وآمنه ، على سبيل المثال ، تشعيع الدماغ بأكمله في حالة النقائل.
من الأورام الخبيثة
تلف هذا العضو. مع تحسين القاعدة العلمية والتكنولوجية للعلاج الإشعاعي: ظهور تقنيات جديدة لإيصال جرعة من الإشعاع المؤين ، وأنظمة التخطيط ، والتحقق من خطط العلاج الإشعاعي عن بعد ، والتصور ، وتثبيت المرضى ، وتطوير علم الأحياء الإشعاعي - أطباء الأورام بالإشعاع تلقى سلاحًا هائلاً في مكافحة مرض الكبد النقيلي - الجراحة الإشعاعية التجسيمية لأورام العضو المشار إليه.
الجراحة الإشعاعية التجسيمية
في التسعينيات من القرن الماضي ، ظهرت الأعمال الأولى في الأدبيات الأجنبية حول استصواب إجراء الجراحة الإشعاعية التجسيمية المحلية (جراحة إشعاع الجسم بالتوضيع التجسيمي - SBRS) لانبثاث الكبد الفردي (حتى 3 بؤر).
فيما يتعلق ب السمات البيولوجيةمرض الكبد المنتشر في سرطان القولون ، يتم فصل المرضى في هذه المجموعة إلى مجموعة فرعية منفصلة. مقاييس الذهب العلاج المحلينقائل الكبد ، ولا سيما نقائل سرطان القولون والمستقيم ، هي استئصال الكبد. تظهر العديد من الدراسات الكبيرة معدل البقاء على قيد الحياة بنسبة 50٪ بعد خمس سنوات من الجراحة. تاريخيًا ، كان يُعتقد أنه من الممكن إجراء استئصال الكبد في تلك الحالات التي يمكن فيها إزالة عدد محدود من النقائل تمامًا بهامش استئصال سلبي يزيد عن سنتيمتر واحد وحجم الكبد المتبقي بعد العملية ، وهو ما يكفي لأداء وظيفي مناسب. العضو (30٪ على الأقل من الحجم الوظيفي الكلي للكبد). إذا تم اتباع هذه المعايير ، يكون الاستئصال ممكنًا في 30-40 ٪ من المرضى الذين يحتاجون إليه. في الوقت الحالي ، من الممكن إزالة أكثر من سبعة نقائل من الكبد في وقت واحد ، وقد ثبت أن عرض هامش الاستئصال السلبي لا يؤثر على التحكم المحلي وبقاء المريض. في المراكز الكبيرة التي تتعامل مع هذه المشكلة ، يتم تقليل مخاطر حدوث مضاعفات ما بعد الجراحة والوفيات إلى الحد الأدنى من القيم. علاوة على ذلك ، الاستئصال المتكرر لسرطان الكبد المتكرر آمن تمامًا.
وتقدم نفس فوائد البقاء على قيد الحياة مثل الاستئصال لأول مرة. لسوء الحظ ، المرضى الذين يعانون من البيلوبار المتزامن ، كبير الحجم ، غير مناسب للتدخل الجراحي النقائل والمظاهر خارج الكبد للمرض ، أولئك الذين لا يترك استئصالهم نسبة 30 ٪ الضرورية من الكبد ، والمرضى الأكبر من سبعين عامًا والمثقلون جسديًا ، غالبًا ما يتم التعرف عليهم على أنهم غير قابل للكسر ، واتباع هذا المنطق ، غير قابل للشفاء. بالإضافة إلى ذلك ، لا توجد تجارب عشوائية تقارن تأثير الاستئصال مقابل العلاج الموضعي غير الجراحي المحافظ في المرضى الذين يمكن استئصالهم.
ظهور التطورات التقنية المبتكرة (التخطيط ثلاثي الأبعاد ، الموازاة متعددة الأوراق ، العلاج الإشعاعي مع العلاج الإشعاعي المعدل الشدة (IMRT) ، طرق التثبيت الأكثر تقدمًا) ، مما زاد بشكل كبير من إمكانية توفير الإشعاع المؤين بدقة لحجم محدد ، وبالتالي بتزويده بجرعة أعلى لحجم الورم ، غيرت فكرة دور العلاج الإشعاعي في علاج نقائل الكبد. يُطلق على أحد أنواع العلاج الإشعاعي عالي الدقة الذي يتم فيه إعطاء جرعة جرَّية في 1-5 أجزاء العلاج الإشعاعي التجسيمي. عند استخدامه خارج الجمجمة ، يُسمى هذا النوع من العلاج الإشعاعي جراحة إشعاع الجسم بالتوجيه التجسيمي (SBRS). وفقًا لتعريف ASTRO ، يتضمن SBRS توصيل جرعات كبيرة من الإشعاع المؤين بتوافق عالٍ وتدرج جرعة حاد في الأنسجة الطبيعية المحيطة في عدد صغير من الكسور (اثنان إلى ستة) للأورام الموجودة خارج الدماغ.
هناك العديد من المنشورات المتعلقة باستخدام SBRS لعلاج آفات الكبد الخبيثة ، والتي تظهر نتائج مشجعة. أقدمها يعود إلى 1994-1995. في هذه الورقة ، قدم الباحثون النتائج الأولى لـ SBRT على 42 ورمًا خارج الجمجمة.
في 31 مريضا. خضع 23 مريضا للعلاج الإشعاعي لانبثاث الكبد (14 مريضا) أو سرطان الخلايا الكبدية (9 مرضى). كان لدى معظم المرضى أورام انفرادية في الكبد والرئتين والفضاء خلف الصفاق. تراوحت أحجام انتشار الورم تحت الإكلينيكي (CTV - حجم الهدف السريري) من 2 إلى 622 سم في 14.2 غراي) ، وتم إحضارها من 1-4 كسور. لاحظ الباحثون وجود سيطرة موضعية في 80٪ من الحالات خلال الحياة اللاحقة للمرضى والتي استمرت من 1.5 إلى 38 شهرًا. بالإضافة إلى اختفاء الأورام أو تقليل حجمها في خمسين بالمائة من الحالات. كان متوسط فترة المتابعة 10 أشهر للمرضى المصابين بسرطان الخلايا الكبدية (من 1 إلى 38 شهرًا) و 9 أشهر للمرضى الذين يعانون من نقائل الكبد (تتراوح من 1.5 إلى 23 شهرًا).
في عام 1998 ، أبلغت نفس المجموعة البحثية عن تجربة استخدام الجراحة الإشعاعية التجسيمية لعلاج أورام الكبد الخبيثة والنقيلة الأولية ، وكان SOD من 15 إلى 45 Gy تلخيصها في 1-5 كسور. تم علاج خمسين مريضا يعانون من 75 ورما. تراوحت الأحجام المعالجة من 2 إلى 732 سم 3 (بمتوسط 73 سم 3). أثناء المتابعة ، بمتوسط 12 شهرًا (تراوحت القيم من 1.5 إلى 38 شهرًا) ، استقر حوالي 30٪ من الأورام ، وانكمش حوالي 40٪ من الأورام ، وتراجع 32٪ تمامًا. تم تفسير أربعة (5.3٪) أورام على أنها إخفاقات محلية. لسوء الحظ، متوسط مدةكان العمر 13.4 شهرًا فقط (بقيم من 1.5 إلى 39 شهرًا) مع غلبة أسباب الوفاة من تليف الكبد التدريجي أو التقدم خارج الكبد للمرض الأساسي.
جرعات 20 جراي (كسرين) أو 15 جراي (ثلاثة كسور). خلال فترة المتابعة من 13 إلى 101 شهرًا ، تم تحقيق السيطرة المحلية على جميع الأورام المتكررة مع الانحدار الكامل للانبثاث في حالتين. كان لدى مريض واحد فقط تطور موضعي للمرض على شكل تلف في فصين من العضو ، والذي سبقه انتشار المرض خارج الكبد. توفي أحد المرضى بعد ذلك لأسباب غير متعلقة بالأورام في غياب علامات المرض الأساسي ، وتوفي اثنان من تعميم العملية الخبيثة ، وكان مريض واحد في نهاية الدراسة في حالة مغفرة لمدة 101 شهرًا بعد الجراحة الإشعاعية التجسيمية.
داوسون وآخرون إجراء SBRT على 16 مريضًا يعانون من نقائل الكبد و 27 مريضًا مصابًا بسرطان الخلايا الكبدية الأولية باستخدام العلاج الإشعاعي المطابق ثلاثي الأبعاد بجرعة متوسطة من 58.5 Gy (28.5 إلى 90 Gy) بمعدل 1.5 Gy للكسر مرتين يوميًا. كانت هناك حالة واحدة من الدرجة الثالثة من RILD ولم تكن هناك وفيات مرتبطة بالعلاج. في دراسة أحدث أجراها Dawson et al. نمذجة إمكانية حدوث مضاعفات من الأنسجة الطبيعية لتطوير RILD في غضون 4 أشهر بعد العلاج الإشعاعي المطابق لانبثاث الكبد أو الأورام الصفراوية داخل الكبد. أظهرت الدراسة تأثيرًا كبيرًا للحجم والجرعة البؤرية الفردية على التنبؤ بتطور RILD في التحليلات متعددة المتغيرات. كانت العوامل المؤهبة الأخرى لتطور RILD هي أمراض الكبد الأولية (سرطان القنوات الصفراوية وسرطان الخلايا الكبدية مقابل المرض النقيلي) والجنس الذكري. وقد لوحظ أن هؤلاء المرضى كانوا يتلقون أيضًا علاجًا كيميائيًا موضعيًا متزامنًا ، كما أن استخدام بروموديوكسيوريدين (مقابل فلوروديوكسيوريدين) كان مرتبطًا أيضًا بزيادة خطر الإصابة بـ RILD. لم تكن هناك حالات تطور RILD عندما تم إعطاء متوسط الجرعة البؤرية الكلية أقل من 31 Gy في الكبد.
في عام 2001 Herfarth et al. أجرى دراسة فحصت تأثير
إمكانيات الجراحة الإشعاعية التجسيمية في علاج مرضى النقائل الكبدية
فعالية SBRS في 37 مريضا مع 60 آفة في الكبد. كانت الجرعة الممتصة 26 غراي وحجم الأورام يتراوح من 1 إلى 132 سم 3 بمتوسط 10 سم 3. تحمل جميع المرضى العلاج جيدًا ، ولم يؤد SBRS إلى أي حالة من الآثار الجانبية الهامة. أبلغ أحد عشر مريضًا عن فقد متقطع للشهية أو غثيان خفيف في غضون أسبوع إلى ثلاثة أسابيع بعد نهاية العلاج. لم يصاب أي من المرضى المعالجين بمرض كبدي يمكن اكتشافه سريريًا. نتيجة لـ SBRS لمدة 5.7 شهرًا (تتراوح من 1 إلى 26.1 شهرًا) ، أظهر أربعة وخمسون من أصل خمسة وخمسين (98 ٪) من الأورام تأثيرًا إيجابيًا ، وفقًا للتصوير المقطعي المحوسب الذي تم إجراؤه بعد 6 أسابيع (22 حالة من حالات استقرار المرض ، 28) حالات استجابة جزئية و 4 حالات استجابة كاملة). كان التأثير الإيجابي المحلي 81٪ خلال 18 شهرًا بعد انتهاء العلاج.
وولف وآخرون. أبلغت عن نتائج SBRS في خمسة مرضى مصابين بسرطان الكبد الأولي و 39 مريضًا يعانون من 51 نقيلة كبدية أجريت في جامعة Wurzburg. تم تخصيص ثمانية وعشرين ورمًا لما يسمى بمجموعة "الجرعة المنخفضة" في ثلاثة أجزاء من 10 جراي (27 مريضًا) أو أربع جلسات من 7 جراي (مريض واحد). بالإضافة إلى ذلك ، كان هناك ما يسمى بمجموعة "الجرعات العالية" ، حيث تعرض المرضى لـ SBRS بجرعات مفردة من 12-12.5 Gy في ثلاثة كسور (19 مريضًا) أو 26 Gy لكل جزء (9 مرضى). كان متوسط المتابعة 15 شهرًا (من 2 إلى 48 شهرًا) لسرطان الكبد الأولي و 15 شهرًا (من 2 إلى 85 شهرًا) في المرضى الذين يعانون من نقائل الكبد. في جميع حالات مرض الكبد الخبيث الأولي ، تم تحقيق تأثير إيجابي ، بما في ذلك التثبيت الحقيقي. من بين 51 نقيلة ، لوحظت 9 حالات تكرار محلي خلال فترة تتراوح من ثلاثة إلى 19 شهرًا. كان هناك ارتباط معنوي محدد بين مجموع جرعة الإشعاع ودرجات التحكم الموضعي (P = 0.077) مع درجات التحكم المحلية بنسبة 86 ٪ و 58 ٪ في 12 و 24 شهرًا.
في مجموعة "الجرعة المنخفضة" مقابل 100٪ و 82٪ في مجموعة "الجرعة العالية" على التوالي. لم تكن هناك حالات تلف إشعاعي من الدرجة الثالثة أو أعلى من RTOG-EORTC. في التحليل متعدد المتغيرات ، كانت الجرعة العالية مقابل الجرعة المنخفضة هي المؤشر الوحيد المهم لدرجات التحكم المحلية (P = 0.0089). بلغ معدل البقاء على قيد الحياة لمدة عام وسنتين بين جميع المرضى 72٪ و 32٪ على التوالي. استنتج المؤلفون أن SBRS للأمراض الخبيثة الأولية وأورام الكبد النقيلي هو علاج محلي فعال دون مضاعفات كبيرة للمرضى الذين حُرموا من الجراحة.
في دراسة أجراها Hoyer et al. ، يتم عرض نتائج استخدام SBRS في علاج نقائل سرطان القولون والمستقيم. أربعة وستون مريضًا لديهم إجمالي 141 نقيلة لسرطان القولون والمستقيم في الكبد (44 مريضًا) أو الرئتين (20 مريضًا) تعرضوا لـ SBRS في ثلاثة أجزاء من 15 Gy لمدة خمسة إلى ثمانية أيام. كان متوسط المتابعة 4.3 سنوات ، وبعد عامين ، كانت معدلات المراقبة المحلية 86٪. كانت السمية الإشعاعية في معظم الحالات معتدلة ، ومع ذلك ، تم تسجيل ثلاث حالات من الأحداث الضائرة الخطيرة وحالة وفاة واحدة. خلص الباحثون إلى أن SBRS لانبثاث سرطان القولون والمستقيم غير القابل للتشغيل ليس أدنى من الطرق الأخرى لاستئصال النقائل الموضعية.
في وقت لاحق إلى حد ما ، Schefter et al. ذكرت النتائج الأولية من دراسة متعددة المراكز من المرحلة الأولى لـ SBRS في المرضى الذين يعانون من نقائل الكبد. كان لدى المرضى من واحد إلى ثلاثة نقائل في الكبد ، مع قطر أقصى للورم أقل من ستة سنتيمترات ، ووظيفة كبد مناسبة. تعرض بعض المرضى لـ SBRS بجرعة إجمالية قدرها 36 Gy في ثلاثة كسور. تلقى جزء آخر من المرضى جرعات أعلى من الإشعاع تصل إلى 60 جراي في ثلاثة كسور. يجب أن يكون ما لا يقل عن 700 مل من أنسجة الكبد السليمة قد تلقت جرعة إجمالية أقل من 15 جراي. تم اختيار السمية المحددة للجرعة كمظاهر للضرر الإشعاعي الحاد للكبد أو الأمعاء من الدرجة الثالثة أو أي مظاهر للضرر الإشعاعي الحاد.
دنيا الرابع درجة. لم يكن لدى أي من المرضى إصابة إشعاعية محددة للجرعة ، لذلك تم رفع جرعة الإشعاع إلى 60 جراي في ثلاثة كسور. كان 12 من 18 مريضًا على قيد الحياة في وقت تحليل المحققين ، بمتوسط 7.1 شهرًا بعد الدخول في البروتوكول.
استمرت الدراسة في عام 2006 بواسطة Kavanagh et al. أبلغت عن نتائج تحليل المرحلة الأولى / الثانية لدراسة مستقبلية لاستخدام SBRS لعلاج النقائل الكبدية. في هذه الحالة ، اشتملت الدراسة على مرضى لا يزيد عددهم عن ثلاثة أورام يبلغ قطرها الأقصى أقل من ستة سنتيمترات. كانت الجرعة البؤرية الإجمالية 60 غراي في ثلاثة كسور لمدة ثلاثة إلى أربعة عشر يومًا. في عام 2006 ، تم نشر النتائج المؤقتة لـ 36 مريضًا مصابًا بـ SBRS: 18 من المرحلة الأولى و 18 من المرحلة الثانية. من بين 21 مريضًا مع فترة متابعة تتراوح من ستة إلى 29 شهرًا ، كانت هناك حالة واحدة فقط من الإصابة الإشعاعية من الدرجة الثالثة RTOG المرتبطة بـ SBRS المنفذة ، والتي حدثت في الأنسجة تحت الجلد. ولم تسجل حالات سمية إشعاعية من الدرجة الرابعة. لاحظ الباحثون أنه بالنسبة لـ 28 آفة على مدى ثمانية عشر شهرًا ، كان التأثير الإيجابي ، بما في ذلك التثبيت الحقيقي ، 93 ٪.
في عام 2009 ، Rusthoven et al. نشر نتائج دراسة متعددة المراكز (أجريت بين أغسطس 2003 وأكتوبر 2007 في 7 مستشفيات) دراسة المرحلة الأولى / الثانية لاستخدام SBRS في المرضى الذين يعانون من نقائل الكبد. اشتملت الدراسة على المرضى الذين يعانون من 1-3 نقائل في الكبد وأقصى حجم للعقد الفردية أقل من 6 سم ، وتم أخذ المستوى الأولي من البيليروبين والألبومين والبروثرومبين و APTT وأنزيمات الكبد في الاعتبار. لم يُسمح لمدة 14 يومًا من العلاج الكيميائي قبل وبعد SBRS. بالنسبة لـ 49 آفة منتشرة ، كانت معدلات التحكم الموضعية 95٪ (سنة واحدة بعد SBRS) و 92٪ (سنتان بعد SBRS). في 2 ٪ من المرضى ، تم الكشف عن إصابات إشعاعية من الدرجة الثالثة وما فوقها بمتوسط 7.5 شهر بعد الجراحة الإشعاعية التجسيمية. كان معدل التأثير المحلي الإيجابي لمدة عامين للنقائل التي يصل قطرها إلى 3.0 سم يساوي
مائة٪. هذا هو أعلى معدل فائدة تم الإبلاغ عنه على الرغم من أن معدل البقاء على قيد الحياة لمدة عامين يبلغ 30٪. استنتج المؤلفون أن الجراحة الإشعاعية بالتوضيع التجسيمي بجرعة إجمالية 60 جراي لكل ثلاثة كسور آمنة وفعالة في علاج المرضى الذين يعانون من نقائل كبدية واحدة إلى ثلاثة.
فان دير بول وآخرون. قدم دراسة في عام 2010 حيث تلقى 20 مريضًا يعانون من نقائل الكبد SBRS بجرعات تتراوح من 30 إلى 37.5 جراي في ثلاثة أجزاء. تم الحصول على مؤشرات مائة بالمائة من وجود تأثير محلي إيجابي بعد عام واحد من العلاج. بعد عامين ، انخفض هذا المعدل إلى 74 ٪ ، بمتوسط بقاء لمدة 34 شهرًا. من بين الإصابات الإشعاعية ، تم ملاحظة حالة واحدة لكسر في الضلع وحالتين لزيادة إنزيمات الكبد من الدرجة الثالثة عواقب طويلة المدىالعلاج الإشعاعي.
أيضًا في عام 2010 ، ظهرت نتائج دراسة مستقبلية أجراها Goodman et al. ، حيث خضع 26 مريضًا يعانون من أورام الكبد الخبيثة (19 منهم مصابين بآفات منتشرة) SBRS بجزء واحد بمبلغ 18-30 جراي. كانت معدلات التأثير المحلي بعد 12 شهرًا 77٪. كان معدل البقاء على قيد الحياة لمدة عامين للمرضى الذين يعانون من نقائل الكبد 49 ٪.
في عام 2011 ، بعد إعادة المعدات التقنية ، سميت مؤسسة ميزانية الدولة الفيدرالية التابعة لمركز أبحاث السرطان الروسي باسم. قدمت NN Blokhin RAMS في الممارسة السريرية لعلاج المرضى الذين يعانون من نقائل الكبد تقنية الجراحة الإشعاعية الموضعية المجسمة (SBRS). تسمح لك هذه التقنية بتكوين جرعة عالية من الإشعاع المؤين محليًا في عقدة ورم منتشر وتسبب تدمير الورم. أدى هذا الاتجاه الواعد في علاج سرطان الكبد النقيلي إلى زيادة كبيرة في إمكانيات العلاج المشترك.
من أغسطس 2010 إلى يوليو 2013 في قسم الأشعة التابع لمعهد الميزانية الفيدرالية التابع لمركز أبحاث السرطان الروسي. أجرى N.N. Blokhin RAMS SBRS خمسة وثلاثين مريضًا يعانون من نقائل الكبد من أورام مختلفة الهياكل النسيجية. جرعة بؤرية واحدة تتراوح من عشرة إلى عشرين جراي ، تم إجراء الجراحة الإشعاعية
إمكانيات الجراحة الإشعاعية التجسيمية في علاج مرضى النقائل الكبدية
لثلاث جلسات في غضون 5-7 أيام. لم يقدم مريضان بيانات فحص المتابعة ، وفي حالتين أخريين ، تم تسجيل تقدم موضعي. كان لدى سبعة مرضى انحدار كامل للورم ، وثلاثة عشر لديهم انحدار جزئي للورم ، وأحد عشر لديهم استقرار في الآفات المعالجة. بعد ذلك ، طور خمسة مرضى آفات نقيلية جديدة في مناطق غير معالجة من الكبد. كان متوسط المتابعة 17 شهرًا. في أي من الحالات ، تم تسجيل إصابات إشعاعية مبكرة ومتأخرة من الدرجة الثالثة إلى الرابعة ، وكان تواتر تطور الإصابات الإشعاعية من الدرجة الثانية 9٪.
استنتاج
فقط مع توافر المعدات والتقنيات الحديثة ، هناك احتمالات لاستخدام الجراحة الإشعاعية التجسيمية في علاج المرضى الذين يعانون من نقائل الكبد. هذه التقنية هي بديل حقيقي للطرق الأخرى للتأثير المحلي على التكوينات المنتشرة. البيانات المقدمة من المؤلفين الأجانب ، فضلاً عن تجربة قسم الأشعة التابع لمعهد الميزانية الفيدرالية التابع لمركز أبحاث السرطان الروسي المسمى على اسم N.N. يشهد N.N. Blokhin من الأكاديمية الروسية للعلوم الطبية على الكفاءة والأمان العاليين لهذه التكنولوجيا ، حتى في المرضى الذين يُحرمون من طرق العلاج الأخرى.
حالة سريرية
المريض أ. 65 سنة. سرطان القولون السيني ، ورم خبيث في الكبد ، T4N1M1 ، المرحلة الرابعة.
في 7 يونيو 2010 ، خضع المريض لعملية استئصال القولون السيني الملطفة. 29.07.10 - استئصال الكبد الأيسر ، الاستئصال الفص الأيمنكبد.
كشف الفحص النسيجي عن سرطان غدي.
بعد العملية تم تنفيذ 8 دورات من العلاج الكيميائي.
في أغسطس 2011 ، وفقًا لبيانات الموجات فوق الصوتية من 08/15/11 ، تم الكشف عن تطور المرض في شكل ورم خبيث انفرادي في الجزء المتبقي من الكبد.
بحلول 17 نوفمبر 2011 ، تم إجراء 7 دورات من العلاج الكيميائي.
وفقًا لبيانات التصوير المقطعي المحوسب بتاريخ 26 أكتوبر 2011 ، تم اكتشاف كتلة تصل إلى 2.7x2.5 سم بين البوابة والأوردة الكبدية اليمنى ، في الجزء السابع كان التركيز يصل إلى 0.9 سم (الشكل 1).
وفقًا لبيانات التصوير بالرنين المغناطيسي من 12/14/11 في منطقة الاستئصال في مقاطع S5-S8 ، تصل العقدة إلى 1.8 سم ، بالقرب من الوريد البابي. في الأجزاء S6-7 ، يتم تحديد عقدة تصل إلى 0.5 سم.
من 21 ديسمبر 2011 إلى 27 ديسمبر 2011 ، تم إجراء دورة الجراحة الإشعاعية التجسيمية على كلا الآفات في الكبد باستخدام تقنية IMRT ، ROD 15 Gy ، 3 مرات في الأسبوع ، SOD 45 Gy.
تم إصلاح المريض باستخدام فراش فراش فردي ،
تم إجراء التحقق من برنامج التشعيع باستخدام تقنية التصوير المقطعي المحوسب في شعاع مخروطي على منضدة معجل خطي في موضع المعالجة.
وفقًا لبيانات التصوير المقطعي المحوسب بتاريخ 15 مايو 2012 ، ظهرت آفة جديدة في S6 من الكبد ، يصل حجمها إلى 1.7 سم ، ولم يتم تصور بؤرتين خضعتا للعلاج الإشعاعي التجسيمي (الشكل 2).
بعد ذلك ، تلقى المريض العلاج في كوريا الجنوبية. في يوليو 2012 وفبراير 2013 ، تردد الراديو
استئصال التركيز في S6 للكبد. لاحظ المريض زيادة في درجة حرارة الجسم لفترة طويلة ، تم الكشف عن خراج في موقع ورم خبيث في S6 من الكبد. في 21 أغسطس 2013 ، تم إجراء تدخل جراحي: في المناطق المرئية من الكبد دون علامات على وجود عملية خبيثة ، في منطقة التركيز المقطوع في المقطع S6 - الخلايا السرطانية على طول حافة القطع.
المريض على قيد الحياة حاليا. وبحسب فحص أغسطس 2013 ، لم يتم العثور على أي علامات للمرض.
المؤلفات
1. هوير م ، سواميناث أ ، بيدر س ، وآخرون. العلاج الإشعاعي لانبثاث الكبد: مراجعة للأدلة. Int ياء راديات أونكول بيول فيز. 2012. V. 82 (3). ص 1047-57.
2. Lax I. ، Blomgren H. ، Naslund I. ، et al. العلاج الإشعاعي التجسيمي لأورام البطن. الجوانب المنهجية. اكتا اونكول. 1994. V. 32 P. 677-683.
3. Poston G. J. الاستراتيجيات الجراحية لانبثاث الكبد القولون والمستقيم. سورج أونكول 2004. V.13. ص 125-36.
4. de Haas R. J. ، Wicherts D. A. ، Flores E. ، et al. استئصال R1 بالضرورة في القولون والمستقيم
النقائل: هل ما زالت موانع للجراحة؟ آن سورج. 2008. V. 248 (4). ص 626-37.
5. دي جونغ إم سي ، مايو إس سي ، بوليتانو سي ، وآخرون. تعد جراحة الكبد المتكررة بغرض العلاج آمنة وفعالة في حالة نقائل الكبد القولونية والمستقيم المتكررة: نتائج من تحليل دولي متعدد المؤسسات. ياء الجهاز الهضمي سورج. 2009. V. 13 (12). ص 2141-51.
6. الخزافون L. ، Kavanagh B. ، Galvin J.M ، وآخرون. ممارسة الجمعية الأمريكية للأشعة العلاجية وعلم الأورام (ASTRO) والكلية الأمريكية للأشعة (ACR) لأداء العلاج الإشعاعي بالتوضيع التجسيمي للجسم.
إمكانيات الجراحة الإشعاعية التجسيمية في علاج مرضى النقائل الكبدية
Int ياء راديات أونكول بيول فيز. 2010. V. 76. P. 326-332.
7. Blomgren H.، Lax I.، Näslund I.، Svanströ
م ر. العلاج الإشعاعي بجرعة عالية من التوضيع التجسيمي للأورام خارج الجمجمة باستخدام مسرع. الخبرة السريرية لأول واحد وثلاثين مريضاً. اكتا اونكول. 1995. V. 33. P. 861-70.
8. Blomgren H. ، Lax I. ، Goranson H. ، et al. الجراحة الإشعاعية لأورام الجسم: تجربة إكلينيكية بطريقة جديدة. J Radiosurg. 1998. V. 1. P. 63-74.
9. Gunven P ، Blomgren H ، Lax I. الجراحة الإشعاعية لتكرار نقائل الكبد بعد استئصال الكبد. أمراض الجهاز الهضمي. 2003. V. 50 (53).
10. داوسون إل إيه ، ماكجين سي جيه ، نورمول دي ، وآخرون. إشعاع الكبد البؤري المتصاعد وفلورودوكسيوريدين الشريان الكبدي المتزامن للأورام الخبيثة داخل الكبد التي لا يمكن استئصالها. ياء نوتر أونكول. 2000.
V. 18. ص 2210-2218.
11. داوسون إل إيه ، نورمول د ، بالتر جيه إم وآخرون. تحليل مرض الكبد الناجم عن الإشعاع باستخدام نموذج Lyman NTCP. Int ياء راديات أونكول بيول فيز. 2002. V. 53 (4). ص 810-821.
12. Herfarth K. K. ، Debus J. ، Lohr F. ، et al. العلاج الإشعاعي التجسيمي أحادي الجرعة لأورام الكبد: نتائج المرحلة الأولى / الثانية. مجلة علم الأورام السريري. 2001. V. 19. ص 164-170.
13. وولف جيه ، جوكنبيرجر إم ، هايدنجر يو وآخرون. العلاج الإشعاعي التجسيمي لسرطان الكبد الأولي
والنقائل الكبدية. اكتا اونكول. 2006. V. 45 (7). ص 838-47.
14. هوير م ، رود هـ ، هانسن أ ت ، وآخرون. دراسة المرحلة الثانية على العلاج الإشعاعي بالتوضيع التجسيمي للجسم لانبثاث القولون والمستقيم. اكتا اونكول. 2006. V. 45. P. 823-830.
15. Schefter T. E. ، Kavanagh B. D. ، Timmerman R. D. ، et al. تجربة المرحلة الأولى من العلاج الإشعاعي بالتوضيع التجسيمي للجسم (SBRT) لانبثاث الكبد. Int ياء راديات أونكول بيول فيز. 2005. V. 62. P. 1371-1378.
16. كافانا بي دي ، شيفتر تي إي ، كاردينيس إتش آر ، وآخرون. التحليل المؤقت لتجربة المرحلة الأولى / الثانية من SBRT لانبثاث الكبد. اكتا اونكول. 2006. V. 45. P. 848-855.
17. روستهوفن ك إي ، كافانا بي دي ، كاردينيس إتش وآخرون. تجربة متعددة المؤسسات في المرحلة الأولى / الثانية من العلاج الإشعاعي بالتوضيع التجسيمي للجسم لانبثاث الكبد. ياء نوتر أونكول. 2009. V. 27. P. 1572-1578.
18. فان دير بول A. E. ، منديز روميرو A. ، Wunderink W. ، وآخرون. العلاج الإشعاعي التجسيمي للجسم لانبثاث الكبد القولون والمستقيم. BrJ سورج. 2010. V. 97. P. 377-382.
19. Goodman K. A. ، Wiegner E. A. ، Maturen K. E. ، et al. دراسة تصعيد الجرعة للعلاج الإشعاعي بالتوضيع التجسيمي على جزء واحد من الجسم لأورام الكبد الخبيثة. Int ياء راديات أونكول بيول فيز. 2010. V. 78. P. 486-493.