Функции антител. Антитела, структура и функции Биологические свойства антител
Читайте также
Антитела (иммуноглобулины , ИГ, Ig) - это особый класс гликопротеинов, присутствующих на поверхности В-клеток в виде мембраносвязанных рецепторов и в сыворотке крови и тканевой жидкости в виде растворимых молекул. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов - например, бактерий и вирусов. Антитела выполняют две функции: антиген -связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом - характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
Антитела состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов антител (иммуноглобулинов) - IgG, IgA, IgM, IgD, IgE, различающихся между собой по строению и аминокислотному составу тяжёлых цепей и по выполняемым эффекторным функциям.
История изучения
Самое первое антитело было обнаружено Берингом и Китазато в 1890 году , однако в это время о природе обнаруженного столбнячного антитоксина , кроме его специфичности и его присутствия в сыворотке иммунного животного, ничего определенного сказать было нельзя. Только с 1937 года - исследований Тизелиуса и Кабата, начинается изучение молекулярной природы антител. Авторы использовали метод электрофореза белков и продемонстрировали увеличение гамма-глобулиновой фракции сыворотки крови иммунизированных животных. Адсорбция сыворотки антигеном , который был взят для иммунизации, снижала количество белка в данной фракции до уровня интактных животных.
Строение антител
Общий план строения иммуноглобулинов: 1) Fab ; 2) Fc ; 3) тяжелая цепь; 4) легкая цепь; 5) антиген-связывающийся участок; 6) шарнирный участок
Антитела являются относительно крупными (~150 кДа - IgG) гликопротеинами , имеющими сложное строение. Состоят из двух идентичныхтяжелых цепей (H-цепи, в свою очередь состоящие из V H , C H1 , шарнира, C H2 и C H3 доменов) и из двух идентичных лёгких цепей (L-цепей, состоящих из V L и C L доменов). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding - антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable - фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA) так и в олигомерной форме (димер-секреторный IgA, пентамер - IgM). Всего различают пять типов тяжелых цепей (α-, γ-, δ-, ε-и μ- цепи) и два типа легких цепей (κ-цепь и λ-цепь).
Классификация по тяжелым цепям
Различают пять классов (изотипов ) иммуноглобулинов, различающихся:
последовательностью аминокислот
величиной
Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA - на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип определяется последовательностью аминокислот константной области тяжелой цепи.
Функции антител
Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа
распознает и связывает антиген, а затем
усиливает киллинг и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов.
Одна область молекулы антител (Fab) определяет ее антигенную специфичность, а другая (Fc) осуществляет эффекторные функции: связывание с рецепторами, которые экспрессированы на клетках организма (например, фагоцитах); связывание с первым компонентом (C1q) системы комплемента для инициации классического пути каскада комплемента.
IgG является основным иммуноглобулином сыворотки здорового человека (составляет 70-75 % всей фракции иммуноглобулинов), наиболее активен во вторичном иммунном ответе и антитоксическом иммунитете. Благодаря малым размерам (коэффициент седиментации 7S, молекулярная масса 146 кДа) является единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивающей иммунитет плода и новорожденного. В составе IgG 2-3 % углеводов ; два антигенсвязывающих F ab -фрагмента и один F C -фрагмент. F ab -фрагмент (50-52 кДа) состоит из целой L-цепи и N-концевой половины H-цепи, соединённых между собой дисульфидной связью , тогда как F C -фрагмент (48 кДа) образован C-концевыми половинами H-цепей. Всего в молекуле IgG 12 доменов (участки, сформированные из β-структуры и α-спиралей полипептидных цепей Ig в виде неупорядоченных образований, связанных между собой дисульфидными мостиками аминокислотных остатков внутри каждой цепи): по 4 на тяжёлых и по 2 на лёгких цепях.
IgM представляют собой пентамер основной четырехцепочечной единицы, содержащей две μ-цепи. При этом каждый пентамер содержит одну копию полипептида с J-цепью (20 кДа), который синтезируется антителообразующей клеткой и ковалентно связывается между двумя соседними F C -фрагментами иммуноглобулина. Появляются при первичном иммунном ответе B-лимфоцитами на неизвестный антиген, составляют до 10 % фракции иммуноглобулинов. Являются наиболее крупными иммуноглобулинами (970 кДа). Содержат 10-12 % углеводов. Образование IgM происходит ещё в пре-B-лимфоцитах, в которых первично синтезируются из μ-цепи; синтез лёгких цепей в пре-B-клетках обеспечивает их связывание с μ-цепями, в результате образуются функционально активные IgM, которые встраиваются в поверхностные структуры плазматической мембраны, выполняя роль антиген распознающего рецептора; с этого момента клетки пре-B-лимфоцитов становятся зрелыми и способны участвовать в иммунном ответе.
IgA сывороточный IgA составляет 15-20 % всей фракции иммуноглобулинов, при этом 80 % молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом , содержится в серозно-слизистых секретах (например в слюне , слезах, молозиве , молоке , отделяемом слизистой оболочки мочеполовой и респираторной системы). Содержит 10-12 % углеводов, молекулярная масса 500 кДа.
IgD составляет менее одного процента фракции иммуноглобулинов плазмы, содержится в основном на мембране некоторых В-лимфоцитов. Функции до конца не выяснены, предположительно является антигенным рецептором с высоким содержанием связанных с белком углеводов для В-лимфоцитов, еще не представлявшихся антигену . Молекулярная масса 175 кДа.
Классификация по антигенам
так называемые «антитела-свидетели заболевания» , наличие которых в организме сигнализирует о знакомстве иммунной системы с данным возбудителем в прошлом или о текущем инфицировании этим возбудителем, но которые не играют существенной роли в борьбе организма с возбудителем (не обезвреживают ни самого возбудителя, ни его токсины, а связываются со второстепенными белками возбудителя).
аутоагрессивные антитела , или аутологичные антитела, аутоантитела - антитела, вызывающие разрушение или повреждение нормальных, здоровых тканей самого организма хозяина и запускающие механизм развития аутоиммунных заболеваний .
аллореактивные антитела, или гомологичные антитела, аллоантитела - антитела против антигенов тканей или клеток других организмов того же биологического вида. Аллоантитела играют важную роль в процессах отторжения аллотрансплантантов, например, при пересадке почки , печени , костного мозга , и в реакциях на переливание несовместимой крови.
гетерологичные антитела, или изоантитела - антитела против антигенов тканей или клеток организмов других биологических видов. Изоантитела являются причиной невозможности осуществления ксенотрансплантации даже между эволюционно близкими видами (например, невозможна пересадка печени шимпанзе человеку) или видами, имеющими близкие иммунологические и антигенные характеристики (невозможна пересадка органов свиньи человеку).
антиидиотипические антитела - антитела против антител, вырабатываемых самим же организмом. Причём это антитела не «вообще» против молекулы данного антитела, а именно против рабочего, «распознающего» участка антитела, так называемого идиотипа. Антиидиотипические антитела играют важную роль в связывании и обезвреживании избытка антител, в иммунной регуляции выработки антител. Кроме того, антиидиотипическое «антитело против антитела» зеркально повторяет пространственную конфигурацию исходного антигена, против которого было выработано исходное антитело. И тем самым антиидиотипическое антитело служит для организма фактором иммунологической памяти, аналогом исходного антигена, который остаётся в организме и после уничтожения исходных антигенов. В свою очередь, против антиидиотипических антител могут вырабатываться анти-антиидиотипические антитела и т. д.
Специфичность антител
Имеет в виду то, что каждый лимфоцит синтезирует антитела только одной определенной специфичности. И эти антитела располагаются на поверхности этого лимфоцита в качестве рецепторов.
Как показывают опыты, все поверхностные иммуноглобулины клетки имеют одинаковый идиотип: когда растворимый антиген , похожий на полимеризованный флагеллин , связывается со специфической клеткой, то все иммуноглобулины клеточной поверхности связываются с данным антигеном и они имеют одинаковую специфичность то есть одинаковый идиотип.
Антиген связывается с рецепторами, затем избирательно активирует клетку с образованием большого количества антител. И так как клетка синтезирует антитела только одной специфичности, то эта специфичность должна совпадать со специфичностью начального поверхностного рецептора.
Специфичность взаимодействия антител с антигенами не абсолютна, они могут в разной степени перекрестно реагировать с другими антигенами. Антисыворотка , полученная к одному антигену, может реагировать с родственным антигеном, несущим одну или несколько одинаковых или похожих детерминант . Поэтому каждое антитело может реагировать не только с антигеном, который вызвал его образование, но и с другими, иногда совершенно неродственными молекулами. Специфичность антител определяется аминокислотной последовательностью их вариабельных областей.
Клонально-селекционная теория :
Антитела и лимфоциты с нужной специфичностью уже существуют в организме до первого контакта с антигеном.
Лимфоциты, которые участвуют в иммунном ответе, имеют антигенспецифические рецепторы на поверхности своей мембраны. У B-лимфоцитов рецепторы- молекулы той же специфичности, что и антитела, которые лимфоциты впоследствии продуцируют и секретируют.
Любой лимфоцит несет на своей поверхности рецепторы только одной специфичности.
Лимфоциты, имеющие антиген , проходят стадию пролиферации и формируют большой клон плазматических клеток. Плазматические клетки синтезируют антитела только той специфичности, на которую был запрограммирован лимфоцит-предшественник. Сигналами к пролиферации служат цитокины , которые выделяются другими клетками. Лимфоциты могут сами выделять цитокины.
Вариабельность антител
Антитела являются чрезвычайно вариабельными (в организме одного человека может существовать до 10 8 вариантов антител). Все разнообразие антител проистекает из вариабельности как тяжёлых цепей, так и лёгких цепей. У антител, вырабатываемых тем или иным организмом в ответ на те или иные антигены, выделяют:
Изотипическая вариабельность - проявляется в наличии классов антител (изотипов), различающихся по строению тяжёлых цепей и олигомерностью, вырабатываемых всеми организмами данного вида;
Аллотипическая вариабельность - проявляется на индивидуальном уровне в пределах данного вида в виде вариабельности аллелей иммуноглобулинов - является генетически детерминированным отличием данного организма от другого;
Идиотипическая вариабельность - проявляется в различии аминокислотного состава антиген-связывающего участка. Это касается вариабельных и гипервариабельных доменов тяжёлой и лёгкой цепей, непосредственно контактирующих с антигеном.
Контроль пролиферации
Наиболее эффективный контролирующий механизм заключается в том, что продукт реакции одновременно служит ее ингибитором . Этот тип отрицательной обратной связи имеет место при образовании антител. Действие антител нельзя объяснить просто нейтрализацией антигена, потому что целые молекулы IgG подавляют синтез антител намного эффективнее, чем F(ab")2 -фрагменты. Предполагают, что блокада продуктивной фазы T-зависимого B-клеточного ответа возникает в результате образования перекрестных связей между антигеном, IgG и Fc - рецепторами на поверхности B-клеток. Инъекция IgM, усиливает иммунный ответ . Так как антитела именно этого изотипа появляются первыми после введения антигена, то на ранней стадии иммунного ответа им приписывается усиливающая роль.
Связывающую и эффекторную (вызывают тот или иной иммунный ответ , например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками , которыми становятся некоторые В-лимфоциты, в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом - характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
Антитела состоят из двух лёгких и двух тяжёлых цепей. У млекопитающих выделяют пять классов антител (иммуноглобулинов) - IgG, IgA, IgM, IgD, IgE, различающихся между собой по строению и аминокислотному составу тяжёлых цепей и по выполняемым эффекторным функциям.
Энциклопедичный YouTube
-
1 / 5
Самое первое антитело было обнаружено Берингом и Китазато в 1890 году , однако в то время о природе обнаруженного столбнячного антитоксина, кроме его специфичности и его присутствия в сыворотке иммунного животного, ничего определенного сказать было нельзя. Только с 1937 года - исследований Тиселиуса и Кабата, началось изучение молекулярной природы антител. Авторы использовали метод электрофореза белков и продемонстрировали увеличение гамма-глобулиновой фракции сыворотки крови иммунизированных животных. Адсорбция сыворотки антигеном , который был взят для иммунизации, снижала количество белка в данной фракции до уровня интактных животных.
Строение антител
Антитела являются относительно крупными (~150 кДа - IgG) гликопротеинами , имеющими сложное строение. Состоят из двух идентичных тяжелых цепей (H-цепи, в свою очередь состоящие из V H , C Н 1, шарнира, C H 2- и C H 3-доменов) и из двух идентичных лёгких цепей (L-цепей, состоящих из V L - и C L - доменов). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding - антиген-связывающий фрагмент) и один (англ. fragment crystallizable - фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA), так и в олигомерной форме (димер-секреторный IgA, пентамер - IgM). Всего различают пять типов тяжелых цепей (α-, γ-, δ-, ε- и μ-цепи) и два типа легких цепей (κ-цепь и λ-цепь).
Классификация по тяжелым цепям
Различают пять классов (изотипов ) иммуноглобулинов, различающихся:
- последовательностью аминокислот
- молекулярной массой
- зарядом
Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA - на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип определяется последовательностью аминокислот константной области тяжелой цепи.
Функции антител
Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа
- распознает и связывает антиген, а затем
- усиливает уничтожение и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов.
Одна область молекулы антител (Fab) определяет её антигенную специфичность, а другая (Fc) осуществляет эффекторные функции: связывание с рецепторами, которые экспрессированы на клетках организма (например, фагоцитах); связывание с первым компонентом (C1q) системы комплемента для инициации классического пути каскада комплемента.
Имеет в виду то, что каждый лимфоцит синтезирует антитела только одной определенной специфичности. И эти антитела располагаются на поверхности этого лимфоцита в качестве рецепторов.
Как показывают опыты, все поверхностные иммуноглобулины клетки имеют одинаковый идиотип: когда растворимый антиген , похожий на полимеризованный флагеллин , связывается со специфической клеткой, то все иммуноглобулины клеточной поверхности связываются с данным антигеном и они имеют одинаковую специфичность то есть одинаковый идиотип.
Антиген связывается с рецепторами, затем избирательно активирует клетку с образованием большого количества антител. И так как клетка синтезирует антитела только одной специфичности, то эта специфичность должна совпадать со специфичностью начального поверхностного рецептора.
Специфичность взаимодействия антител с антигенами не абсолютна, они могут в разной степени перекрестно реагировать с другими антигенами. Антисыворотка, полученная к одному антигену, может реагировать с родственным антигеном, несущим одну или несколько одинаковых или похожих детерминант . Поэтому каждое антитело может реагировать не только с антигеном, который вызвал его образование, но и с другими, иногда совершенно неродственными молекулами. Специфичность антител определяется аминокислотной последовательностью их вариабельных областей.
Клонально-селекционная теория :
- Антитела и лимфоциты с нужной специфичностью уже существуют в организме до первого контакта с антигеном.
- Лимфоциты, которые участвуют в иммунном ответе, имеют антигенспецифические рецепторы на поверхности своей мембраны. У B-лимфоцитов рецепторы- молекулы той же специфичности, что и антитела, которые лимфоциты впоследствии продуцируют и секретируют.
- Любой лимфоцит несет на своей поверхности рецепторы только одной специфичности.
- Лимфоциты, имеющие антиген , проходят стадию пролиферации и формируют большой клон плазматических клеток. Плазматические клетки синтезируют антитела только той специфичности, на которую был запрограммирован лимфоцит-предшественник. Сигналами к пролиферации служат цитокины , которые выделяются другими клетками. Лимфоциты могут сами выделять цитокины.
Вариабельность антител
Антитела являются чрезвычайно вариабельными (в организме одного человека может существовать до 10 8 вариантов антител). Все разнообразие антител проистекает из вариабельности как тяжёлых цепей, так и лёгких цепей. У антител, вырабатываемых тем или иным организмом в ответ на те или иные антигены, выделяют:
- Изотипическая вариабельность - проявляется в наличии классов антител (изотипов), различающихся по строению тяжёлых цепей и олигомерностью, вырабатываемых всеми организмами данного вида;
- Аллотипическая вариабельность - проявляется на индивидуальном уровне в пределах данного вида в виде вариабельности аллелей иммуноглобулинов - является генетически детерминированным отличием данного организма от другого;
- Идиотипическая вариабельность - проявляется в различии аминокислотного состава антиген-связывающего участка. Это касается вариабельных и гипервариабельных доменов тяжёлой и лёгкой цепей, непосредственно контактирующих с антигеном.
Контроль пролиферации
Наиболее эффективный контролирующий механизм заключается в том, что продукт реакции одновременно служит её ингибитором . Этот тип отрицательной обратной связи имеет место при образовании антител. Действие антител нельзя объяснить просто нейтрализацией антигена, потому что целые молекулы IgG подавляют синтез антител намного эффективнее, чем F(ab")2 -фрагменты. Предполагают, что блокада продуктивной фазы T-зависимого B-клеточного ответа возникает в результате образования перекрестных связей между антигеном, IgG и Fc - рецепторами на поверхности B-клеток. Инъекция IgM усиливает иммунный ответ . Так как антитела именно этого изотипа появляются первыми после введения антигена, то на ранней стадии иммунного ответа им приписывается усиливающая роль.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Биологический факультет
АНТИТЕЛА, КЛАССИФИКАЦИЯ И ФУНКЦИИ
Реферат
студента 4 курса 6 группы
КОВАЛЬЧУКА К.В.
Минск 2004г.
Открытие антител
Строение антител
Классификация антител
Функции антител
Литература
Открытие антител
Термин «антитело» был введён в употребление в конце XIX века. В 1890 году Беринг (Behring) и Китасато (Kitasato) провели эксперименты, в которых они изучали на морских свинках действие дифтерийного и столбнячного токсинов. Они вводили животным сублетальную дозу токсина, через некоторое время брали у них сыворотку и вводили её вместе с летальной дозой токсина другим животным, в результате чего животные не погибали. Был сделан вывод, что после иммунизации токсином в крови животных появляется вещество, способное нейтрализовать его и тем самым предотвратить заболевание. Данное вещество получило название антитоксина, а затем был введён более общий термин - антитело; вещества вызывающие образование антител стали называть антигенами.
Только в 1939 году Тизелиус (Tiselius) и Кэбет (Kabat) показали, что антитела содержатся в определённой фракции белков сыворотки. Они иммунизировали животное овальбумином и из полученной сыворотки взяли две пробы, в одну из них был добавлен овальбумин и образовавшийся осадок (комплекс антитело-овальбумин) удалили. Электрофорез выявил, что в пробе куда добавлялся овальбумин, содержание г-глобулинов значительно ниже чем в другой пробе. Это указывало на то, что антитела являются г-глобулинами. Чтобы отличить их от других белков, содержащихся в этой фракции глобулинов, антитела были названы иммуноглобулинами. Сейчас известно, что антитела обнаруживаются в значительных количествах также во фракциях б- и в-глобулинов.
Структура антител была установлена в ходе разнообразных экспериментов. В основном они заключались в том, что антитела обрабатывались протеолитическими ферментами (папаин, пепсин), и подвергались алкилированию и восстановлению меркаптоэтанолом. Затем исследовались свойства полученных фрагментов: определялась их молекулярная масса (хроматографией), четвертичная структура (рентгеноструктурным анализом), способность связываться с антигеном и т.п. Также использовались антитела к данным фрагментам: выяснялось, могут ли антитела к одному типу фрагментов связываться с фрагментами другого типа. На основе полученных данных была построена описываемая ниже модель молекулы антител.
Строение антител
Молекула антитела состоит из четырёх полипептидных цепей (рис.1): двух тяжёлых (H; мол.масса 50-70 кДа) и двух лёгких (L; мол.масса 23 кДа). Цепи соединены нековалентными связями (водородные, гидрофобные связи) и дисульфидными мостиками и состоят из двух (лёгкая цепь) или четырёх (тяжёлая цепь) доменов длиной около 110 аминокислотных остатков. Вариабельные домены VH и VL, представляющие собой N-концевые участки цепей, образуют антигенсвязывающий сайт. Помимо них лёгкие цепи содержат по одному (СL), а тяжёлые по три-четыре (СH1-4) константных домена.
При ферментативном расщеплении антител протеолитическим ферментом папаином образуются три фрагмента: два идентичных антигенсвязывающих фрагмента (Fab) и один кристаллизуемый фрагмент (Fc). Fab-фрагмент состоит из интактной L-цепи, связанной дисульфидной связью с доменами СH1 и VH, его N-концевая часть (Fv-фрагмент) обладает антигенсвязывающей активностью. Fc-фрагмент состоит из двух соединённых дисульфидной связью пар доменов CH2 и CH3. Данный фрагмент не участвует в связывании антигенов, а выполняет эффекторные функции - реагирование с клетками и факторами комплемента.
Способность связывания антитела с тем или иным антигеном определяется аминокислотным составом вариабельных доменов, а точнее их гипервариабельных участков. Для этих участков характерна очень высокая изменчивость последовательности аминокислот. Каждый VH и VL домен содержит по три гипервариабельных участка, которые собственно и образуют антигенсвязывающие сайты. Последовательности между ними названы каркасными; для них характерна более низкая структурная изменчивость.
Рис. 1. Строение молекулы антитела. H и L, тяжёлая и лёгкая цепи; CDR, гипервариабельные участки.
Аминокислотная последовательность константной области слабо варьирует. Секвенирование лёгкой цепи выявило существование двух основных вариантов аминокислотных последовательностей СL-доменов, что привело к выделению двух типов лёгких цепей - каппа (к) и лямбда (л). Молекула антитела может одновременно содержать либо две к-цепи, либо две л-цепи (у антител человека чаще встречаются к-цепи).
Также определение аминокислотных последовательностей позволило выделить пять типов СH-областей и соответственно - тяжёлых цепей (б, д, е, г, м). Цепи м и е содержат по четыре константных домена, остальные цепи - три константных домена, а также шарнирную область между доменами СH1 и CH2. В зависимости от того, какой тип тяжёлой цепи содержит антитело, различают пять классов иммуноглобулинов: IgA (тяжёлая цепь типа б), IgD (д), IgE (е), IgG (г), IgM (м). Из-за некоторых различий в аминокислотных последовательностях выделяют несколько типов л-цепей, а также несколько типов б- и г-цепей (и соответственно несколько подклассов IgG и IgA). С тяжёлыми цепями (в первую очередь с CH2-доменами) связаны несколько олигосахаридных цепей, которые вероятно увеличивают растворимость антител и участвуют в связывании с компонентами комплемента и клеточными рецепторами.
В доменах полипептидные цепи укладываются формируя в-складчатые слои, в которых антипараллельные цепи соединены петлями (рис.2). Эти петли могут иметь различную длину и аминокислотные последовательности, что очень важно, т.к. именно они формируют антигенсвязывающий сайт. В пределах каждого домена два в-слоя соединены дисульфидной связью и стабилизированы гидрофобными взаимодействиями. Четвертичная структура в форме Y (рис.3) формируется благодаря нековалентным взаимодействиям между доменами. Между доменами CH2 расположены молекулы углеводов, что приводит к выступанию этих доменов и делает их более доступными для взаимодействия с разнообразными молекулами, такими как компоненты системы комплемента.
Рис.2. Двумерная схема укладки полипептидной цепи в пределах домена VL: два в-складчатых слоя, соединённых дисульфидной связью (чёрная полоска).
Рис.3. Схема, показывающая взаимодействие между доменами лёгкой и тяжёлой цепи. Между доменами CH2 расположены молекулы углеводов.Показаны гипервариабельные регионы (CDRs).
Классификация антител
Как уже было упомянуто выше, в зависимости от типа тяжёлой цепи различают пять классов иммуноглобулинов.
IgG составляют большинство антител сыворотки крови. Большинство антител вторичного иммунного ответа и антитоксинов представлено именно иммуноглобулинами класса G. Материнские IgG обеспечивают пассивный иммунитет ребёнка в первые несколько месяцев жизни, попадая в кровь плода через плаценту. IgG активируют систему комплемента и связываются с поверхностными антигенами клеток, делая тем самым эти клетки более доступными для фагоцитоза (опсонизация). Способны связываться с тканями вызывая анафилаксические реакции.
Молекулы IgM состоят из пяти одинаковых четырёхцепочечных субъединиц, соединённых дисульфидными связями. В их составе также присутствует дополнительная полипептидная цепь (J-цепь), образующая домен иммуноглобулинового типа и связанная дисульфидными связями с С-концевыми пептидами (18 аминокислотных остатков) тяжёлых цепей отдельных мономеров.Предположительно она участвует в полимеризации мономеров. Иммуноглобулины класса М содержатся преимущественно в крови. Доминируют в качестве «ранних» антител (первыми появляются при развитии иммунного ответа). Благодаря множеству участков связывания вызывают агглютинацию клеток. Более эффективно, чем IgG активируют комплемент.
IgA преобладают среди антител серозно-слизистых секретов (слюна, молозиво, молоко, секрет дыхательных путей), где они представлены в основном димерной формой. Как и IgM содержат С-концевой пептид, к которому может присоединятся J-цепь, связывая два мономера в димер. С данным комплексом дополнительно связывается белок, называемый секреторным компонентом, который способствует доставке антител в секреты и защищает их от протеолиза. В сыворотке человека представлены в основном мономерной формой, а в сыворотке других млекопитающих в основном димером. Препятствуют проникновению вирусов, микроорганизмов через слизистые оболочки.
IgD и IgE присутствуют в сыворотке в очень низких концентрациях. IgDчасто встречаются на цитоплазматических мембранах В-клеток и предположительно участвуют в антиген-зависимой дифференцировке лимфоцитов. IgEвстречаются на мембранах базофилов и тучных клеток. Участвуют в аллергических реакциях, вызывая секрецию клеткой-носителем IgE гистамина и других вазоактивных веществ, в ответ на связывание молекулы IgE с антигеном. Возможно, играют существенную роль в антигельминтозном иммунитете.
Функции антител
Антитела синтезируются В-лимфоцитами и образующимися из них плазматическими клетками. Их молекулы встроены в цитоплазматическую мембрану В-лимфоцитов, где они функционируют в качестве антигенспецифичных рецепторов. Большинство В-лимфоцитов крови человека экспрессирует на своей поверхности иммуноглобулины двух классов - IgM и IgD. Но в определённых областях тела могут встречаться с высокой частотой В-клетки, несущие антитела других классов (например, IgA в слизистой оболочке кишечника). Плазматические клетки секретируют антитела в плазму крови и тканевую жидкость. Все антитела, синтезируемые одной В-клеткой (или плазматической клеткой), имеют идентичный антигенсвязывающий центр и могут связываться только с одним антигеном.
Первичной функцией антител является связывание с чужеродными (в норме) антигенами с последующей их инактивацией. Антитела способны инактивировать токсины связываясь с зонами молекулы токсина ответственными либо за адсорбцию на клеточных рецепторах либо непосредственно за токсическое действие. Аналогично связывание антител с белками, необходимыми для адсорбции вируса на рецепторы клеток, приводит к инактивации вирионов.
Кроме того, антитела способны вовлекать в иммунный ответ другие элементы иммунной системы: систему комплемента и клетки хозяина. С константными доменами тяжёлой цепи антител классов G и M (с доменами CH2 и CH3 соответственно) способен связываться компонент комплемента C1q. Это вызывает каскад реакций (процесс активации комплемента по классическому пути), в конечном счете приводящих к лизису клетки, с антигенами которой были связаны антитела. Некоторые клетки организма несут на своей поверхности Fc-рецепторы, с которыми посредством Fc-фрагмента могут связываться молекулы антител. Данные рецепторы имеются у макрофагов, что позволяет им распознавать комплексы антиген-антитело с последующим их фагоцитированием (антитела являются опсонинами, т.е. молекулами, которые при связывании с антигенами облегчают их фагоцитирование). Также Fc-фрагмент ответственен за фиксацию антител на клетках определённых тканей и развитие анафилоксических реакций.
К любым антигенам в организме животного изначально существуют антитела. Это предполагает, что каждый организм продуцирует миллионы различных иммуноглобулинов, различающихся своими центрами связывания антигенов. Такое разнообразие обеспечивается несколькими механизмами. Лёгкие и тяжёлые цепи молекул антител кодируются несколькими типами генных сегментов: лёгкая цепь - тремя типами сегментов (V, J, C), тяжёлая - четырьмя (V, D, J, C). В геноме обычно присутствует от нескольких до нескольких сотен сегментов каждого типа, несколько различающихся по нуклеотидной последовательности. Для синтеза цельного полипептида (лёгкой или тяжёлой цепи) необходимо объединение нуклеотидных последовательностей сегментов каждого типа. Такое объединение происходит сначала на уровне ДНК (соматическая рекомбинация), а затем на уровне матричных РНК (сплайсинг). В результате образуется огромное количество вариантов мРНК и соответственно полипептидных цепей. Во время соматической рекомбинации и сплайсинга могут происходить вставки и делеции нуклеотидов, что вместе с повышенной частотой мутаций в генах антител ещё больше повышает разнообразие этих уникальных по своим свойствам белков.
Литература
1. Иммунология / Ройт А., Бростофф Дж., Мейл Д.-М.:Мир, 2000.-592 с.
2. Иммунология: В 3-х т.; т.1 / Под ред. У. Пола.-М.: Мир, 1987-88.-476 с.
Подобные документы
Природа антител, их основные функции и структура. Молекулярное строение антител. Структурно-функциональные особенности иммуноглобулинов различных классов. Механизм взаимодействия антитела с антигеном. Теории разнообразия антител, их ключевые свойства.
реферат , добавлен 22.05.2015
Характеристика иммунной системы, ее структура, предназначение и функции основных органов. Механизм иммунной защиты, выработка антител, основные классы иммуноглобулинов. Особенности последствий дефицита витаминов, их значение для организма человека.
реферат , добавлен 04.06.2010
Технология получения особых антител, которые помогают иммунной системе обнаруживать опухолевые клетки и избавиться от них, разработанная в 1975 г. Г. Колером и Г. Милштейном. Моноклональные антитела в лечении онкологических заболеваний, механизм действия.
презентация , добавлен 04.10.2016
Получение антиидиотипических и моноклональных антител овцы межвидовым слиянием клеток. Области применения моноклональных антител и их методы получения. Применение эрлифтных ферментеров для получения антител. Система управления аффинной хроматографией.
реферат , добавлен 06.08.2009
Методы получения полианилина, его строение и электрохимические свойства. Изучение влияний условий получения полианилина и измерения сигнала сенсора на основе электрода, модифицированного полианилином, на характеристики детектирования антител к ДНК.
курсовая работа , добавлен 20.04.2017
Характеристика системы иммунной защиты организма. Приобретенный иммунитет и его формы. Выработка антител и регуляция их продукции. Образование клеток иммунологической памяти. Возрастные особенности иммунитета, вторичные (приобретенные) иммунодефициты.
реферат , добавлен 11.04.2010
Иммуногенность антигена как способность в организме иммунизированного животного к образованию антител. Понятие "чужеродности" иммуногена, ее зависимость от генетических особенностей иммунизируемого животного. Получение специфических антисывороток.
реферат , добавлен 20.09.2009
Риск поражения иммунной системы человека. Симптомы, профилактика и лечение болезни. Состояние ВИЧ-инфицированного больного. Обнаружение ВИЧ-инфекции с помощью анализа крови на наличие антител. Влияние вируса на иммунную систему. СПИД и его стадии.
реферат , добавлен 24.01.2012
Смысл и основные положения гибридомной технологии. Некоторые приемы, позволяющие усилить иммунный ответ. Использование препаратов, полученных на основе моноклональных антител, которые связываются только с клеточными антигенами раковых клеток (РеоПро).
курсовая работа , добавлен 20.05.2015
Разработка способа получения моноклональных антител на основе гибридомной технологии. Роль гибридомы в фундаментальной иммунологии. Создание на основе клонально-селекционной теории иммунитета. Методы диагностики заболеваний и злокачественных опухолей.
1. Опсонизация (иммунный фагоцитоз).
2. Антитоксический эффект.
3. Активация комплемента.
4. Нейтрализация.
5. Циркулирующие комплексы (связанные растворимые Аг образуют комплесы с Ат, которые выводятся из организма с желчью и мочой).
6. Антителозависимая цитотоксичность.
Динамика антителообразования.
Серологические реакции в лабораторной диагностике инфекционных заболеваний.
В защите организма от чужеродных антигенов решающую роль играют иммунологические механизмы, осуществляющиеся антителами и иммунокомпетентными клетками. Основа иммунологических механизмов – специфическая реакция между антителами или лимфоцитами (образовавшихся под воздействием попавшего в организм антигена) и антигена. Главная функция антител – связывание антигена и его дальнейшее выведение из организма.
Однако такие реакции между антителами и антигенами могут происходить и вне организма (in vitro) в присутствии электролита и возможны лишь при наличии комплементарности (структурного сходства, сродства) антигена и антитела.
Имея специфические антитела против определенного антигена можно распознать и выявить его среди других антигенов, а в сыворотке крови антитела против известного антигена.
Реакция антиген-антитело in vitro сопровождается возникновением определенного феномена – агглютинации, преципитации, лизиса.
Таким образом все серологические реакции используются с двумя целями:
выявление антител в сыворотке больного с помощью стандартных антигенов-диагностикумов (для серологической диагностики инфекционных болезней );
для выявления неизвестных антигенов по известным стандартным сывороткам, содержащим антитела определенной специфичности (для серологической идентификации возбудителей ).
Например, если сыворотка больного реагирует с конкретным микробным антигеном – значит в сыворотке больного есть антитела против данного микроорганизма.
Серологическая диагностика – берут стандартный антиген (диагностикум), представляющий собой инактивированные или живые бактерии, вирусы или же их антигены (компоненты) в изотоническом растворе.
Серологическая идентификация – используют стандартные иммунные сыворотки, которые получают от иммунизированных животных (в крови животных в результате многократной иммунизации возбудителем появляется большое количество антител).
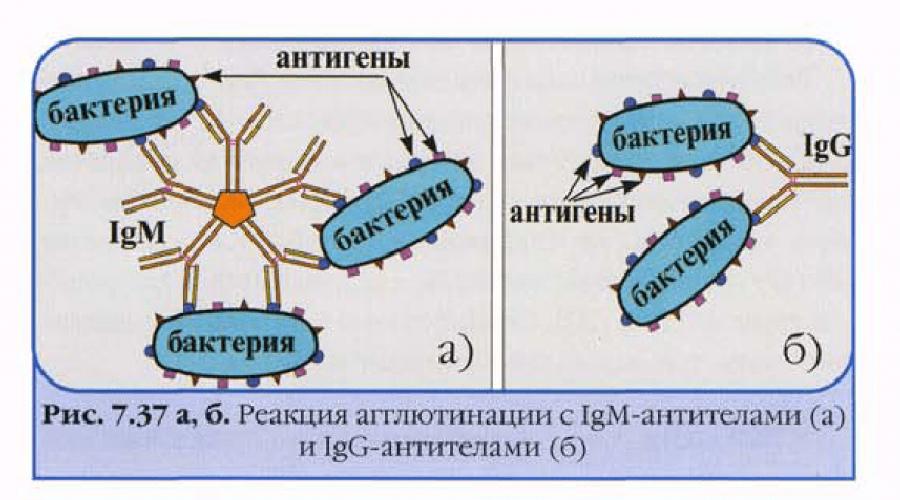
Агглютинация.
Агглютинация – серологическая реакция между антителами (агглютининами) и антигенами (агглютининогенами), размещенными на поверхности бактериальной клетки, а в результате образуется комплекс антиген-антитело (агглютинат).
Механизм агглютинации – под влиянием ионов электролита уменьшается негативный поверхностный заряд бактериальной клетки и следовательно они могут сблизиться на такое расстояние при котором возникает склеивание бактерий.
Макро- и микроскопический вид агглютината :
О-агглютинация (соматическая) – мелкозернистая, при микроскопии – бактерии склеиваются полюсами клеток, образуя сеть.
Vi-агглютинация (капсульная) – мелкозернистая, при микроскопии - склеивание бактерий происходит всей поверхностью клетки.
Н-агглютинация (жгутиковая) – агглютинины взаимодействуют с жгутиками обездвиживая бактерии, при микроскопии – крупнохлопчатая, склеивание бактериальных клеток в области жгутиков.


Реакция агглютинации используется для определения антител в сыворотке крови больных, например, при бруцеллезе (реакции Райта, Хеддельсона), брюшном тифе и паратифах (реакция Видаля) других инфекционных болезнях, а также при определении возбудителя, выделенного от больного. Эту же реакцию применяют для определения групп крови с использованием моноклональных антител против аллоантигенов эритроцитов.
Применяются различные варианты реакции агглютинации: развернутая, ориентировочная, непрямая и др.
Для определения у больного антител ставят развернутую реакцию агглютинации : к разведениям сыворотки крови больного добавляют взвесь убитых микробов (диагностикум) и через несколько часов инкубации при 37°С отмечают наибольше разведение (титр) сыворотки, при котором произошла агглютинация, т.е. образовался осадок.
Характер и скорость агглютинации зависят от вида антигена и антител.
Если необходимо определить возбудитель, выделенный от больного, ставят ориентировочную реакцию агглютинации, применяя диагностические антитела, т.е. проводят серотипирование возбудителя. Ориентировочную реакцию проводят на предметном стекле. К 1 капле диагностической иммунной сыворотки в разведении 1:10 или 1:20 добавляют чистую культуру возбудителя, выделенного от больного. Если появляется хлопьевидный осадок, то реакцию проводят в пробирках с увеличивающимися разведениями диагностической сыворотки, добавлял в каждую дозу сыворотки 2-З капли взвеси возбудителя. Реакцию считают положительной, если агглютинация отмечается в разведении, близком к титру диагностической сыворотки. В контролях (сыворотка, разведенная изотоническим раствором хлорида натрия, или взвесь микробов в том же растворе) осадок в виде хлопьев должен отсутствовать.
Разные родственные бактерии могут агглютинироваться одной и той же диагностической агглютинирующей сывороткой, что затрудняет их идентификацию. Поэтому пользуются адсорбированными агглютинирующими сыворотками, из которых удалены перекрестно реагирующие антитела путем адсорбции их родственными бактериями. В таких сыворотках сохраняются антитела, специфичные только к данной бактерии. Получение таким способом монорецепторных диагностических агглютинирующих сывороток было предложено А.Кастелляни (1902). Реакция непрямой (пассивной) гемагглютинации (РНГА) основана на использовании эритроцитов (или латекса) с адсорбированными на их поверхности антигенами или антителами, взаимодействие которых с соответствующими антителами или антигенами сыворотки крови больных вызывает склеивание и выпадение эритроцитов на дно пробирки или ячейки в виде фестончатого осадка. РНГА применяют для диагностики инфекционных болезней, определения гонадотропного гормона в моче при установлении беременности, для выявления повышенной чувствительности к лекарственным препаратам и гормонам и в некоторых других случаях. Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты. РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных. Реакцию агглютинации для определения групп крови применяют для установления системы АВО с помощью РА эритроцитов, используя антитела к группам крови А(II), В(III). Контролем служит сыворотка, не содержащая антител, т.е. АВ(IV) группы крови, антигены, содержащиеся в эритроцитах групп А(II), В(III); отрицательный контроль не содержит антигенов, т.е. используют эритроциты группы 0 (I). В реакции агглютинации для определения резус-фактора используют антирезусные сыворотки (не менее двух различных серий). При наличии на мембране исследуемых эритроцитов резус-антигена происходит агглютинация этих клеток. Контролем служат стандартные резус-положительные и резус-отрицательные эритроциты всех групп крови.
Реакцию агглютинации для определения антирезусных антител (непрямую реакцию Кумбса) применяют у больных при внутрисосудистом гемолизе. У некоторых таких больных обнаруживают антирезусные антитела, которые являются неполными. Они специфически взаимодействуют с резус-положительными эритроцитами, но не вызывают их агглютинации. Наличие таких неполных антител определяют в непрямой реакции Кумбса. Для этого в систему антирезусные антитела + резус-положительные эритроциты добавляют антиглобулиновую сыворотку (антитела против иммуноглобулинов человека), что вызывает агглютинацию эритроцитов. С помощью реакции Кумбса диагностируют: патологические состояния, связанные с внутрисосудистым лизисом эритроцитов иммунного генеза, например гемолитическую болезнь новорожденных: эритроциты резус-положительного плода соединяются с циркулирующими в крови неполными антителами к резус-фактору, которые перешли через плаценту от резус-отрицательной матери.
Реакция коагглютинации - разновидность РА: клетки возбудителя определяют с помощью стафилококков, предварительно обработанных иммунной диагностической сывороткой. Стафилококки, содержащие белокА, имеющий сродство к иммуноглобулинам, неспецифически адсорбируют антимикробные антитела, которые затем взаимодействуют активными центрами с соответствующими микробами, выделенными от больных. В результате коагглютинации образуются хлопья, состоящие из стафилококков, антител диагностической сыворотки и определяемого микроба.
В ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом - характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
Антитела состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов антител (иммуноглобулинов) - IgG, IgA, IgM, IgD, IgE, различающихся между собой по строению и аминокислотному составу тяжёлых цепей и по выполняемым эффекторным функциям.
История изучения
Самое первое антитело было обнаружено Берингом и Китазато в 1890 году , однако в это время о природе обнаруженного столбнячного антитоксина, кроме его специфичности и его присутствия в сыворотке иммунного животного, ничего определенного сказать было нельзя. Только с 1937 года - исследований Тизелиуса и Кабата, начинается изучение молекулярной природы антител. Авторы использовали метод электрофореза белков и продемонстрировали увеличение гамма-глобулиновой фракции сыворотки крови иммунизированных животных. Адсорбция сыворотки антигеном , который был взят для иммунизации, снижала количество белка в данной фракции до уровня интактных животных.
Строение антител
Антитела являются относительно крупными (~150 кДа - IgG) гликопротеинами , имеющими сложное строение. Состоят из двух идентичных тяжелых цепей (H-цепи, в свою очередь состоящие из V H , C H1 , шарнира, C H2 и C H3 доменов) и из двух идентичных лёгких цепей (L-цепей, состоящих из V L и C L доменов). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding - антиген-связывающий фрагмент) и один (англ. fragment crystallizable - фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA) так и в олигомерной форме (димер-секреторный IgA, пентамер - IgM). Всего различают пять типов тяжелых цепей (α-, γ-, δ-, ε-и μ- цепи) и два типа легких цепей (κ-цепь и λ-цепь).
Классификация по тяжелым цепям
Различают пять классов (изотипов ) иммуноглобулинов, различающихся:
- величиной
- зарядом
- последовательностью аминокислот
- содержанием углеводов
Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA - на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип определяется последовательностью аминокислот константной области тяжелой цепи.
Функции антител
Иммуноглобулины всех изотипов бифункциональны. Это означает, что иммуноглобулин любого типа
- распознает и связывает антиген, а затем
- усиливает киллинг и/или удаление иммунных комплексов, сформированных в результате активации эффекторных механизмов.
Одна область молекулы антител (Fab) определяет ее антигенную специфичность, а другая (Fc) осуществляет эффекторные функции: связывание с рецепторами, которые экспрессированы на клетках организма (например, фагоцитах); связывание с первым компонентом (C1q) системы комплемента для инициации классического пути каскада комплемента.
Имеет в виду то, что каждый лимфоцит синтезирует антитела только одной определенной специфичности. И эти антитела располагаются на поверхности этого лимфоцита в качестве рецепторов.
Как показывают опыты, все поверхностные иммуноглобулины клетки имеют одинаковый идиотип: когда растворимый антиген , похожий на полимеризованный флагеллин , связывается со специфической клеткой, то все иммуноглобулины клеточной поверхности связываются с данным антигеном и они имеют одинаковую специфичность то есть одинаковый идиотип.
Антиген связывается с рецепторами, затем избирательно активирует клетку с образованием большого количества антител. И так как клетка синтезирует антитела только одной специфичности, то эта специфичность должна совпадать со специфичностью начального поверхностного рецептора.
Специфичность взаимодействия антител с антигенами не абсолютна, они могут в разной степени перекрестно реагировать с другими антигенами. Антисыворотка, полученная к одному антигену, может реагировать с родственным антигеном, несущим одну или несколько одинаковых или похожих детерминант . Поэтому каждое антитело может реагировать не только с антигеном, который вызвал его образование, но и с другими, иногда совершенно неродственными молекулами. Специфичность антител определяется аминокислотной последовательностью их вариабельных областей.
Клонально-селекционная теория :
- Антитела и лимфоциты с нужной специфичностью уже существуют в организме до первого контакта с антигеном.
- Лимфоциты, которые участвуют в иммунном ответе, имеют антигенспецифические рецепторы на поверхности своей мембраны. У B-лимфоцитов рецепторы- молекулы той же специфичности, что и антитела, которые лимфоциты впоследствии продуцируют и секретируют.
- Любой лимфоцит несет на своей поверхности рецепторы только одной специфичности.
- Лимфоциты, имеющие антиген , проходят стадию пролиферации и формируют большой клон плазматических клеток. Плазматические клетки синтезируют антитела только той специфичности, на которую был запрограммирован лимфоцит-предшественник. Сигналами к пролиферации служат цитокины , которые выделяются другими клетками. Лимфоциты могут сами выделять цитокины.
Вариабельность антител
Антитела являются чрезвычайно вариабельными (в организме одного человека может существовать до 10 8 вариантов антител). Все разнообразие антител проистекает из вариабельности как тяжёлых цепей, так и лёгких цепей. У антител, вырабатываемых тем или иным организмом в ответ на те или иные антигены, выделяют:
- Изотипическая вариабельность - проявляется в наличии классов антител (изотипов), различающихся по строению тяжёлых цепей и олигомерностью, вырабатываемых всеми организмами данного вида;
- Аллотипическая вариабельность - проявляется на индивидуальном уровне в пределах данного вида в виде вариабельности аллелей иммуноглобулинов - является генетически детерминированным отличием данного организма от другого;
- Идиотипическая вариабельность - проявляется в различии аминокислотного состава антиген-связывающего участка. Это касается вариабельных и гипервариабельных доменов тяжёлой и лёгкой цепей, непосредственно контактирующих с антигеном.
Контроль пролиферации
Наиболее эффективный контролирующий механизм заключается в том, что продукт реакции одновременно служит ее ингибитором . Этот тип отрицательной обратной связи имеет место при образовании антител. Действие антител нельзя объяснить просто нейтрализацией антигена, потому что целые молекулы IgG подавляют синтез антител намного эффективнее, чем F(ab")2 -фрагменты. Предполагают, что блокада продуктивной фазы T-зависимого B-клеточного ответа возникает в результате образования перекрестных связей между антигеном, IgG и Fc - рецепторами на поверхности B-клеток. Инъекция IgM, усиливает иммунный ответ . Так как антитела именно этого изотипа появляются первыми после введения антигена, то на ранней стадии иммунного ответа им приписывается усиливающая роль.
- А. Ройт, Дж. Брюсстофф, Д. Мейл. Иммунология- М.: Мир, 2000 - ISBN 5-03-003362-9
- Иммунология в 3 томах / Под. ред. У. Пола.- М.:Мир, 1988
- В. Г. Галактионов. Иммунология- М.: Изд. МГУ, 1998 - ISBN 5-211-03717-0
См. также
- Абзимы - каталитически активные антитела
- Авидность , аффинность - характеристики связывания антигена и антитела
Иммунная система / Иммунология Системы Адаптивная иммунная система и Врожденная иммунная система · Гуморальная иммунная система и Клеточная иммунная система · Система комплемента (Анафилотоксины) · Intrinsic immunity Антигены и антитела