Денисов д с стереотаксическая лучевая. Стереотаксическая лучевая терапия. Лучевая терапия с модуляцией интенсивности пучка
2
1 МИБС–Медицинский Институт им. Березина Сергея, Санкт-Петербург; ФГБОУ ВО СЗГМУ им. И. И. Мечникова Минздрава России, Санкт-Петербург
2 ООО «ЛДЦ МИБС», Санкт-Петербург
3 ФГБОУ ВО СПбГУ, Санкт-Петербург
4 ФГБУ «Российский научный центр радиологии и хирургических технологий им. акад. А.М. Гранова» Минздрава России, Санкт-Петербург
5 ООО «ЛДЦ МИБС», Санкт-Петербург
Лечение локальных и регионарных рецидивов рака головы и шеи остается важной проблемой онкологии из-за высокой частоты их развития после комбинированного и комплексного лечения. Хирургическое лечение выполнимо не во всех случаях, химиотерапия имеет невысокую эффективность, а повторное облучение с применением конвенциональных методик характеризуется низкими показателями локального контроля, общей выживаемости и высоким риском развития тяжелых поздних лучевых повреждений. Стереотаксическая лучевая терапия в режиме гипофракционирования хорошо зарекомендовала себя в лечении ряда первичных опухолей на ранних стадиях (рак легких, предстательной железы), а также как паллиативное лечение при метастатическом поражении легких, печени, костей и лимфатических узлов. Данный вид лучевого лечения характеризуется хорошей переносимостью и относительно высокой эффективностью, однако четкие рекомендации по выбору режима фракционирования, суммарной дозы, а также толерантным дозам для нормальных тканей в случае применения стереотаксической лучевой терапии в ранее облученных областях в настоящий момент отсутствуют. В обзоре рассмотрено применение стереотаксической лучевой терапии в режиме гипофракционирования для лечения локальных и регионарных рецидивов рака головы и шеи в ранее облученных областях.
Ключевые слова: рак головы и шеи, повторное облучение, рецидив, стереотаксическая лучевая терапия, гипофракционирование.Для цитирования: Михайлов А.В., Воробьев Н.А., Сокуренко В.П., Мартынова Н.И., Гуцало Ю.В. Стереотаксическая лучевая терапия в режиме гипофракционирования в лечении рецидивов опухолей головы и шеи - состояние проблемы // РМЖ. Медицинское обозрение. 2018. №6. С. 22-27
Hypofractionated stereotactic radiation therapy in the treatment of recurrent tumors of head and neck - state of the problem
A.V. Mikhailov 1,2 , N.A.Vorobyov 1-3 , V.P. Sokurenko 4 , N.I. Martynova 1 , Yu.V. Gutsalo 1
1 Medical Institute named after Berezin Sergey (MIBS), St. Petersburg
2 North-Western State Medical University named after I. I. Mechnikov, St. Petersburg
3 St. Petersburg State University, St. Petersburg
4 Russian Scientific Center Of Radiology And Surgical Technologies named after A. M. Granov, St. Petersburg
Treatment of local and regional relapses of head and neck cancer remains an important problem because of the high frequency of their development after combined and complex treatment. Surgical treatment is possible not in all cases, chemotherapy is characterized by low cure rates, and reirradiation with the use of conventional methods provides low rates of local control, overall survival and a high risk of developing severe late radiation toxicity. Hypofractionated stereotactic radiation therapy is effective in the treatment of primary tumors in the early stages (lung cancer, prostate cancer), as well as in the palliative treatment for metastatic tumors of the lungs, liver, bones and lymph nodes. This type of radiation treatment is characterized by good tolerability and relatively high efficacy, but there are currently no clear recommendations for choosing a fractionation regimen, prescription of a total dose, and tolerant doses for normal tissues in the case of stereotactic radiation therapy in previously irradiated regions. Current experience in hypofractonated stereotaxic radiation therapy for the treatment of local and regional recurrences of head and neck cancer in previously irradiated areas is presented in this review.
Key words: head and neck cancer, reirradiation, recurrence, stereotactic radiotherapy, hypofractionation.For citation: Mikhailov A.V., Vorobyov N.A., Sokurenko V.P. уt al. Hypofractionated stereotactic radiation therapy in the treatment of recurrent tumors of head and neck - state of the problem // RMJ. Medical Review. 2018. № 6. P. 22–27.
В обзоре рассмотрено применение стереотаксической лучевой терапии в режиме гипофракционирования для лечения локальных и регионарных рецидивов рака головы и шеи в ранее облученных областях.
Введение
После успешного радикального лечения местно-распространенных форм рака головы и шеи, локорегионарные рецидивы развиваются более чем у 30% пациентов . Оптимальным методом лечения пациентов с рецидивом рака головы и шеи является хирургический, обеспечивающий 36% двухлетнюю безрецидивную и 39% пятилетнюю общую выживаемость, однако прооперировать удается не более 20% больных из-за выраженных постлучевых изменений мягких тканей шеи, близости рецидивной опухоли к магистральным сосудам и тяжелой сопутствующей патологии .Ответ на системное лечение (химиотерапия, таргетная терапия) достигается у 15–25% больных, а медиана безрецидивной и общей выживаемости составляет
5,6 и 10,5 мес. соответственно .
До появления высокоточных методов облучения пациенты с неоперабельными рецидивами опухолей головы и шеи подвергались повторной лучевой терапии в режиме обычного фракционирования с применением методик двухмерного и трехмерного планирования, суммарная доза при использовании которых редко превышала 50 Гр. Основным недостатком применения повторной конвенциональной радиотерапии является поздняя лучевая токсичность III–IV степени, которая развивается более чем у 30% пациентов . По литературным данным, после проведения повторной конвенциональной лучевой терапии конкурентно с химиотерапией прогрессирование заболевания становилось причиной смерти у 90% пациентов. Около 10% пациентов умирали от осложнений, связанных с лечением, а общая пятилетняя выживаемость не превышала 6% .
Эти неутешительные данные указывают на необходимость поиска новых путей лечения данной категории больных, и один из них - конформные методики лучевой терапии с эскалацией суммарной дозы для улучшения показателей локального контроля и общей выживаемости без снижения качества жизни пациентов.
Стереотаксическая лучевая терапия (СЛТ) в режиме гипофракционирования является современным методом радиотерапии, при котором в область мишени подводятся высокие дозы ионизирующего излучения (более 3 Гр за фракцию) за небольшое количество фракций (от 2 до 5) . Лечение и процесс подготовки к нему осуществляется с использованием специальных фиксирующих устройств (подголовники, маски из термопластичного материала, вакуумные матрасы), методик дозиметрического планирования высокой конформности (IMRT - модулированная по интенсивности лучевая терапия, VMAT - объемно-модулированная терапия арками), с контролем лечебного положения с помощью рентгеновской визуализации на современных линейных ускорителях, что позволяет обеспечить требуемую точность облучения.
К достоинствам СЛТ в режиме гипофракционирования относятся более короткий в сравнении со стандартным фракционированием курс лечения, высокая биологически эффективная доза, меньшее количество фракций, что повышает эффективность лечения за счет снижения влияния феномена репопуляции опухоли и в ряде случаев позволяет получить удовлетворительные результаты при облучении радиорезистентных опухолей . Это позволяет рассматривать стереотаксическое облучение как один из методов лечения больных с рецидивами рака головы и шеи.
Гипофракционирование в первичном лечении больных с опухолями головы и шеи
Применение высоких разовых доз изучалось с 1980-х годов. Так, в 1982 г. Weissberg et al. опубликованы результаты проспективного исследования, проведенного на базе Йельского университета, где лучевая терапия с использованием высоких разовых доз применялась с паллиативной целью в лечении злокачественных новообразований головы и шеи с 1973 г. Пациенты рандомизировались в две группы. Больные первой группы облучались в разовой дозе 2 Гр до суммарной дозы 60–70 Гр в течение 6–7 нед., второй группы - 4 Гр до суммарной дозы 44 Гр в течение 2–3-х недель. Лечение проводилось с использованием тормозного излучения с энергией фотонов 2–6 мВ. Большинство пациентов (94% и 88% в первой и второй группах соответственно) имели T4 стадию заболевания. Обе группы характеризовались сопоставимой переносимостью и эффективностью. Пятилетняя безрецидивная выживаемость составила 10% в обеих группах .В литературе описана методика «quad shot» (англ.– «четыре выстрела»), использовавшаяся с паллиативной целью у больных с местно-распространенным процессом в области головы и шеи. Применялся следующий режим фракционирования: 14 Гр за 4 фракции, 2 р./день с интервалом
6 часов. Далее этот режим повторяли с 4-недельными интервалами для дальнейших двух курсов . При этом отмечалась минимальная токсичность и улучшение качества жизни. Объективный ответ на лучевую терапию составил 53%, а у 23% пациентов была достигнута стабилизация процесса. Медиана общей выживаемости составила 5,7 мес., медиана беспрогрессивной выживаемости - 3,1 мес.
О хорошей переносимости лучевой терапии в режиме гипофракционирования свидетельствуют и результаты, опубликованные в 1990 г. Ang et al. В работе сообщалось о безопасности и эффективности использования разовой дозы от 5 Гр и выше у пациентов с меланомой головы и шеи. Разовая доза (6 Гр × 5 фракций) была выбрана на основе радиобиологических особенностей меланомы. У данных пациентов наблюдались высокие показатели локального контроля без какой-либо значимой поздней лучевой токсичности .
С развитием технических возможностей дистанционной лучевой терапии были предприняты попытки применения стереотаксического облучения в высокой разовой дозе в качестве локальной добавки (буста) у пациентов с назофарингеальным раком после курса лучевой терапии в режиме стандартного фракционирования до суммарной дозы 66 Гр . Через 4–6 нед. после завершения курса облучения в режиме обычного фракционирования проводилось однократное подведение дозы от 7 до 15 Гр на область носоглотки. По результатам исследования отмечены хорошие показатели локального контроля (100% трехлетний локальный контроль) на фоне удовлетворительной переносимости и приемлемой частоты развития поздних лучевых повреждений. В исследование было включено 45 больных, лучевая токсичность проявилась в виде неврита черепных нервов у 4-х пациентов, постлучевой ретинопатии - у 1 пациента и бессимптомного радионекроза в височной доле - у 3 пациентов.
Al-Mamgani et al. приводят результаты стереотаксического гипофракционного облучения в качестве локальной добавки после курса дистанционной лучевой терапии в режиме обычного фракционирования у пациентов с плоскоклеточным раком ротоглотки и полости рта, которым традиционно применялся буст при помощи контактной или внутритканевой брахитерапии . После достижения суммарной дозы в режиме стандартного фракционирования проводилось локальное облучение первичной опухоли в разовой дозе 5,5 Гр до суммарной дозы 16,5 Гр
(за 3 фракции). Двухлетние показатели локального контроля, безрецидивной и общей выживаемости составили 86, 80 и 82% соответственно. Перерывов в лечении не зарегистрировано, ранней лучевой токсичности IV степени и выше не отмечено. Поздняя лучевая токсичность при двухлетнем периоде наблюдения развилась у 28% больных. Авторы сделали заключение о высокой эффективности и безопасности стереотаксического облучения в качестве локальной добавки в сравнении с брахитерапией.
Положительный опыт применения СЛТ при первичном лечении рака головы и шеи по критериям онкологической эффективности и безопасности положил начало исследованиям применения данного метода при повторном облучении пациентов с рецидивами злокачественных опухолей головы и шеи.
Повторное стереотаксическое облучение в режиме гипофракционирования при рецидивах рака головы и шеи
Наиболее опасными осложнениями лучевой терапии являются необратимые повреждения центральной нервной системы. Сложность облучения области головы и шеи заключается в близком расположении от облучаемых объемов таких критических структур, как ствол головного мозга, спинной мозг, зрительные нервы, улитка, слуховой нерв, повреждение которых приводит к фатальным последствиям либо значительно ухудшает качество жизни больных . В настоящий момент четкие рекомендации по формированию радиотерапевтических объемов и предписание доз при повторной лучевой терапии отсутствуют, также окончательно не решен вопрос о толерантных дозах для нормальных тканей при повторном облучении .Многие авторы указывают на значение средств медицинской визуализации в формировании радиотерапевтических объемов. Показана значительная роль позитронно-
эмиссионной компьютерной томографии (ПЭТ, ПЭТ-КТ) с глюкозой в определении границ рецидивной опухоли на фоне постлучевых изменений тканей . Deantonio et al. в своем исследовании показали, что макроскопический объем опухоли (Gross Tumor Volume - GTV), сформированный по данным ПЭТ (GTV-PET), был меньше, чем GTV, сформированный по данным КТ (GTV–CT): 17,2 см 3 против 20,0 см 3 , что не было статистически достоверным (p=0,2). Однако клинический объем мишени, сформированный на основании обоих методов визуализации, был достоверно больше, чем определенный только по данным компьютерной томографии, за счет более точного определения границ рецидивной опухоли на фоне постлучевых изменений окружающих тканей .
Выбор режима фракционирования и предписание суммарных доз зависят от толерантных доз для окружающих нормальных тканей и основываются на знаниях о радиобиологии опухолей. При первичном и повторном облучении наиболее часто применяются разовые дозы 6–9 Гр, суммарные - 30–54 Гр, число фракций варьирует от 2 до 7 .
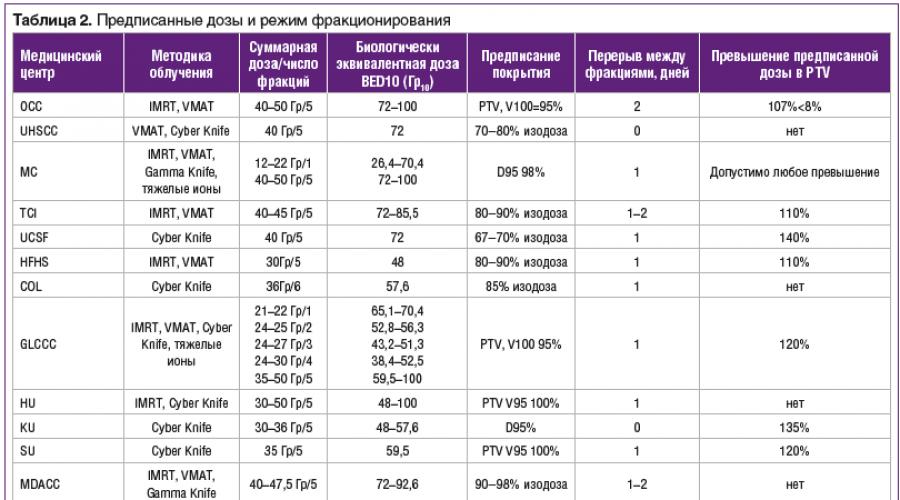
В крупнейших онкологических клиниках США, Европы и Японии накоплен определенный опыт применения СЛТ в режиме гипофракционирования при повторном облучении области головы и шеи . Международным консорциумом по стереотаксической лучевой терапии проведено обобщение опыта ведущих мировых онкологических клиник, результаты этого исследования опубликованы в 2017 г. Данные по формированию радиотерапевтических объемов в различных клиниках приведены в таблице 1.
Следует отметить относительно небольшое количество наблюдений и существенные различия в подходах к формированию облучаемого объема среди центров, предоставивших данные. В большинстве случаев отступы для формирования клинического объема мишени (CTV) и планируемого лечебного объема (PTV) небольшие, от 1 до 3 мм, что обусловлено высокой точностью подведения дозы на используемом оборудовании для реализации лучевой терапии. В некоторых клиниках приоритетно соблюдение толерантных доз для нормальных тканей, тогда как в других - покрытие мишени дозой.
В таблице 2 приведены данные вышеуказанных клиник по предписанию суммарной дозы, режиму фракционирования и техническим средствам реализации лучевой терапии. Наиболее распространенными являются курсы лучевой терапии, включающие от 5 до 6 сеансов облучения с подведением суммарной дозы 35–50 Гр, что биологически эквивалентно 48 –100 Гр для коэффициента α/β=10 Гр. В ряде центров облучение проводилось ежедневно, в других - через день или через два дня. Необходимо отметить различия в подходе к градиентному планированию. В центрах, использовавших системы «Кибер-нож», было разрешено превышение предписанной дозы в мишени до 135%, тогда как в других клиниках, проводящих облучение на линейных ускорителях с многолепестковыми коллиматорами, предписывалось гомогенное покрытие лечебного объема с превышением дозы не более чем на 10–20%.

В таблице 3 приведены толерантные дозы для нормальных тканей при повторном облучении в режиме гипофракционирования, которыми руководствовались в клиниках, принявших участие в опросном исследовании. Эти дозы отражают обобщенные значения и не носят рекомендательного характера. Принятие решения остается за лечащим врачом в зависимости от конкретной клинической ситуации, дозы, полученной тем или иным органом при первичном облучении, а также периода времени, прошедшего между курсами лучевой терапии.

В таблице 4 приведены данные по частоте развития поздних лучевых осложнений, представленные клиниками, принявшими участие в обобщении опыта повторного стереотаксического облучения .

При повторном облучении даже при соблюдении рассмотренных выше предельно допустимых доз отмечается практически двукратное повышение частоты развития таких осложнений, как остеорадионекроз, дисфагия, некроз мягких тканей. Следует отметить, что частота развития фатального кровотечения из сонной артерии, лучевых язв, геморрагического мукозита и формирования свищей существенно не отличается от таковой при первичном облучении. Авторы сходятся во мнении, что риск развития кровотечения из сонной артерии зависит не от объема опухоли, ответа на лечение и интервала времени между курсами облучения, а от степени охвата стенки сосуда опухолью. Выявлена корреляция между частотой развития кровотечений и охватом опухолью более 180° окружности сосудистой стенки. В таблице 4 приведено сравнение частоты поздних осложнений лучевой терапии в режиме гипофракционирования при первичном и повторном облучении области головы и шеи.
Сочетание повторного стереотаксического облучения в режиме гипофракционирования при рецидивах рака головы и шеи с системным лечением
Одним из способов преодоления радиорезистентности рецидивной опухоли является применение системного компонента одновременно с локальным облучением. Поскольку эффективные классические цитостатики, как правило, уже были применены при лечении первичной опухоли, методом выбора становится таргетная терапия. Одним из наиболее изученных таргетных препаратов, применяемых при плоскоклеточном раке головы и шеи, является цетуксимаб . Особого внимания заслуживают рандомизированные исследования, проведенные коллективом Института рака Питтсбургского университета. В своем исследовании Heron et al. рандомизировали больных в группы СЛТ в режиме гипофракционирования (n=35) и комбинации СЛТ с еженедельным введением цетуксимаба (n=35). Полный ответ получен у 34,3% пациентов, которым была выполнена только СЛТ, и у 45,7% больных, которым проводилось комбинированное лечение с цетуксимабом. Однолетний и двухлетний локальный контроль составил 53,8% и 33,6% для пациентов только с СЛТ, и 78,6% и 49,2% соответственно для пациентов, подвергшихся комбинированному лечению (p=0,009). Однолетняя и двухлетняя общая выживаемость составили 52,7% и 21,1% для пациентов, получавших только СЛТ, и 66% и 53,5% - для пациентов, получавших комбинированное лечение соответственно (p=0,31) .Результаты этой работы использовались в качестве обоснования для открытия второй фазы исследования повторного облучения рецидивных опухолей головы и шеи с помощью СЛТ конкурентно с цетуксимабом. В данном исследовании 50 пациентов получили цетуксимаб
(400 мг/м2 на 7-й день и 240 мг/м2 в дни с 1-го по 8-й) конкурентно с повторной СЛТ в суммарной дозе 40–44 Гр за 5 фракций. Медиана наблюдения составила 18 мес. Среди выживших к данному сроку наблюдения пациентов однолетняя выживаемость до локального прогрессирования составила 60%, локорегионарного - 37%, отдаленного - 71%. Годичная общая выживаемость для всех пациентов, включенных в исследование, составила 40%. Отмечена хорошая переносимость лечения с частотой развития поздних лучевых осложнений III степени и выше у 6% больных . Авторы пришли к заключению о возможности безопасного и эффективного применения данного режима при паллиативном лечении у больных с рецидивами плоскоклеточного рака головы и шеи.
Заключение
На сегодняшний день стереотаксическая лучевая терапия в режиме гипофракционирования как при самостоятельном применении, так и в комбинации с системными агентами, представляется эффективным и относительно безопасным способом лечения больных с рецидивами рака головы и шеи. Анализ накопленного к настоящему моменту опыта применения данного метода выявляет гетерогенность исследованных групп больных по подходам к формированию объемов облучения, а также предписанию разовых и суммарных доз, что диктует необходимость проведения дальнейших исследований влияния данных параметров на эффективность лечения, частоту и характер наблюдаемых осложнений.Литература
1. Patel P. R., Salama J. K. Reirradiation for recurrent head and neck cancer // Expert Rev. Anticancer Ther. 2012. Vol. 12. P.1177–1189.
2. McDonald M.W., Lawson J., Garg M. K. et al. ACR appropriateness criteria retreatment of recurrent head and neck cancer after prior definitive radiation expert panel on radiation oncology-head and neck cancer // Int. J Radiat. Oncol. Biol. Phys. 2011. Vol. 80. P.1292–1298.
3. Сокуренко В. П., Михайлов А. В., Воробьев Н. А. и др. Возможности повторной лучевой терапии больных с рецидивом плоскоклеточного рака головы и шеи // Лучевая диагностика и терапия. 2017. Т.8. Вып. 1. С.82–87 .
4. Goodwin W. J. Jr. Salvage surgery for patients with recurrent squamous cell carcinoma of the upper aerodigestive tract: when do the ends justify the means? // Laryngoscope. 2000. Vol. 110. Suppl. 93. P.1–18.
5. Clavel M., Vermorken J. B., Cognetti F. et al. Randomized comparison of cisplatin, methotrexate, bleomycin and vincristine (CABO) versus cisplatin and 5-fluorouracil (CF) versus cisplatin (C) in recurrent or metastatic squamouscell carcinoma of the head and neck. A phase III study of the EORTC Head and Neck Cancer Cooperative Group // Ann. Oncol. 1994/ Vol. 5. P.521–526.
6. Strojan P., Corry J., Eisbruch A. et al. Recurrent and second primary squamous cell carcinoma of the head and neck: When and how to reirradiate // Head Neck. 2015. Vol. 37. P.134–150.
7. Spencer S. A., Harris J., Wheeler R. H. et al. RTOG 96–10: reirradiation with concurrent hydroxyurea and 5-fluorouracil in patients with squamous cell cancer of the head and neck // Int. J. Radiat. Oncol. Biol. Phys. 2001. Vol. 51. P.1299–1304.
8. Le Q. T., Tate D., Koong A. et al. Improved local control with stereotactic radiosurgical boost in patients with nasopharyngeal carcinoma // Int. J. Radiat. Oncol. Biol. Phys. 2003. Vol. 56. P.1046–1054.
9. Timmerman R. D., Herman J., Cho L. C. Emergence of stereotactic body radiation therapy and its impact on current and future clinical practice // J. Clin. Oncol. 2014. Vol. 32. P.2847–2854.
10. Weissberg J. B., Son Y. H., Percarpio B., Fischer J. J. Randomized trial of conventional versus high fractional dose radiation therapy in the treatment of advanced head and neck cancer // Int. J. Radiat. Oncol. Biol. Phys. 1982. Vol. 8. P.179–185.
11. Corry J., Peters L. J., Costa I. D. et al. The ‘QUAD SHOT’– a phase II study of palliative radiotherapy for incurable head and neck cancer // Radiother Oncol. 2005. Vol. 77. P.137–142.
12. Ang K. K., Byers R. M., Peters L. J. et al. Regional radiotherapy as adjuvant treatment for head and neck malignant melanoma. Preliminary results // Arch. Otolaryngol. Head Neck Surg. 1990. Vol. 116. P.169–172.
13. Le Q. T., Tate D., Koong A. et al. Improved local control with stereotactic radiosurgical boost in patients with nasopharyngeal carcinoma // Int. J. Radiat. Oncol. Biol. Phys. 2003. Vol. 56. P.1046–1054.
14. Al-Mamgani A., Tans L., Teguh D. N., van Rooij P. et al. Stereotactic body radiotherapy: a promising treatment option for the boost of oropharyngeal cancers not suitable for brachytherapy: a single-institutional experience // Int. J. Radiat. Oncol. Biol. Phys. 2012. Vol. 82. P.1494–1500.
15. Roh K. W., Jang J. S., Kim M. S. et al. Fractionated stereotactic radiotherapy as reirradiation for locally recurrent head and neck cancer // Int. J. Radiat. Oncol. Biol. Phys. 2009. Vol. 74. P.1348–1355.
16. Moule R. N., Kayani I., Moinuddin S. A. et al. The potential advantages of (18) FDG PET/CT-based target volume delineation in radiotherapy planning of head and neck cancer // Radiother. Oncol. 2010. Vol. 97. P.189–193.
17. Deantonio L., Beldi D., Gambaro G. et al. FDG-PET/CT imaging for staging and radiotherapy treatment planning of head and neck carcinoma // Radiat. Oncol. 2008. Vol. 3. P.29.
18. Kodani N., Yamazaki H., Tsubokura T. et al. Stereotactic body radiation therapy for head and neck tumor: disease control and morbidity outcomes // J. Radiat. Res. 2011. Vol. 52. P.24–31.
19. Karam I., Yao M., Heron D. E. et al. Survey of current practices from the International Stereotactic Body Radiotherapy Consortium for head and neck cancers // Future oncology. 2017. Vol. 13. P.603–613.
20. Vermorken J. В., Mesia R., Rivera F. et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer // N. Engl. J. Med. 2008. Vol. 359. P 1116–1127.
21. Heron D. E., Rwigema J. C., Gibson M. K. et al. Concurrent cetuximab with stereotactic body radiotherapy for recurrent squamous cell carcinoma of the head and neck: a single institution matched case-control study // Am. J. Clin. Oncol. 2011. Vol. 34. P.165–172.
22. Vargo J. A., Ferris R. L., Ohr J. et al. A prospective phase 2 trial of reirradiation with stereotactic body radiation therapy plus cetuximab in patients with previously irradiated recurrent squamous cell carcinoma of the head and neck // Int. J. Radiat. Oncol. Biol. Phys. 2015. Vol. 91. P.480–488.
Облучение в онкологической практике – одна из основных тактик лечения. Его применяют при большинстве злокачественных новообразований как совместно с другими видами терапии, так и самостоятельно. Лучевая терапия (ЛТ), одной из методик которой является радиохирургия, при раке желудка назначается очень часто. Её эффективность и преимущества для пациентов, заключающиеся в повышении показателей выживаемости и улучшении жизни человека, неоспоримы и давно подтверждены клинической практикой.
Радиация против рака
При проведении курса ЛТ для уменьшения размеров злокачественного новообразования применяют излучение ионизирующего типа, имеющее высокие энергетические показатели. Оно оказывает непосредственное влияние на мутировавшие клетки только того внутреннего органа, на который направлено воздействие. Лечение рака желудка при помощи такого облучения чаще всего проводится совместно с химиотерапией.
Новейшие методики и установки современной онкологии позволили расширить показания к проведению данных процедур. В настоящее время в клинической практике онкологических заболеваний применяется несколько видов облучения желудочного рака, среди которых самым востребованным считается стереотаксическая радиохирургия. Использование данной методики позволяет удалять злокачественные опухоли без проведения традиционного оперативного вмешательства, одним лишь воздействием на них пучка высокочастотной радиации. При этом на здоровые ткани не оказывается никакого травмирующего воздействия.
Среди установок, в которых применяют такой подход, самыми популярными в онкологической практике устранения злокачественных новообразований из системы ЖКТ считаются кибер-нож и True Beam (гипофракционный метод, уничтожающий аномальные ткани любой локализации).
Также достаточно высокую результативность показывают следующие методы ЛТ:
- IGRT метод, сопровождающийся визуальным контролем. Такая лучевая терапия при раке желудка проводится с применением во время процедуры частой съёмки. Методы визуализации (рентген, позитронно-эмиссионная томография, ультразвук, МРТ, КТ) подбираются для каждого пациента в индивидуальном порядке. Такая методика позволяет производить прицельную доставку точно рассчитанной дозы радиации непосредственно к очагу поражения, даже если он совершает функциональные движения.
- 3D-CRT, или трёхмерная конформная лучевая терапия. Облучение рака желудка при её проведении бывает объёмным, полностью повторяющим форму опухоли за счёт точного скрещивания на ней 3-х пучков радиационного излучения, выпускаемых из разных источников. По отдельности они очень слабые и потому не травмируют здоровые ткани.
- IMRT (РТМИ) метод с модулируемой интенсивностью. Такое облучение при раке желудка даёт специалисту возможность подобрать наиболее точную дозу изотопного излучения к объёмной по форме опухоли, так как он может самостоятельно регулировать и изменять его интенсивность. Также при помощи IMRT онкологи, которыми проводится такая радиохирургия, могут свести к минимуму повреждение важных структур благодаря возможности сосредотачивать в аномальных зонах основного пищеварительного органа самые высокие дозы радиации.
Самым же продвинутым вариантом считается у медиков томотерапия. Данная процедура сочетает в себе возможности и преимущества IMRT и IGRT методик. В современной клинической практике такое многообразие вариантов ЛТ позволяет ведущим онкологам выбирать для лечения определённых видов злокачественных новообразований оптимальные инструменты.
Механизм действия ионизирующего излучения
Многих пациентов, у которых диагностирована онкология в системе пищеварения, интересует вопрос о том, как именно уничтожаются мутировавшие клетки при помощи этого метода. Их гибель непосредственно связана с разрушением в молекуле ДНК рака ядра, мембранного комплекса и дезоксинуклеопротеидов, сложных белков, содержащих входящий в состав хромосом хроматин. Это приводит к нарушениям в облучённых клетках всех метаболических (обменных) процессов.
Морфологически изменения, происходящие в поражённых тканях, характеризуются тремя этапами:
- первичное повреждение новообразования;
- начало процесса отмирания;
- замещение разрушенных структур.
Отмирание мутировавших клеток и их рассасывание начинаются не сразу, в связи с этим результат проведённого лечения полностью оценить можно только через некоторое время после его окончания.
Предоперационная лучевая терапия при раке желудка
Хотя хирургическое воздействие и считается главным методом, избавляющим человека от злокачественных новообразований в основном пищеварительном органе, достаточно эффективным оно бывает только в том случае, когда предваряется курсом ЛТ.
Облучение при раке желудка, проведённое непосредственно перед операцией позволяет достигнуть следующих положительных эффектов:
- уменьшает размеры существующей опухоли;
- притормаживает прорастание в близлежащие и отдалённые органы метастазов;
- удлиняет период болезни, протекающий без рецидивов;
- увеличивает пятилетнюю выживаемость.
Но широкому применению данного метода мешает достаточно высокая радиорезистентность (невосприимчивость к ионизирующему излучению) опухолей основного органа пищеварения и быстрое привыкание к радиации слизистых. Помимо этого в клинической практике проведения ЛТ у некоторых пациентов отмечалось и такие негативные явления, как затягивание предоперационного периода, а также увеличение числа осложнений при минимальном разрушении опухоли.
Важно! Для того, что чтобы лучевая терапия при раке желудка принесла по-настоящему действенные результаты и не вызвала дополнительных проблем со здоровьем, планирование предполагаемого курса лечения ионизирующим излучением должно проводиться со всей тщательностью. Также во время проведения терапии пациент должен неукоснительно соблюдать все рекомендации лечащего врача.
Подбирая циклы предоперационного облучения онкологами учитываются такие задачи данной лечебной методики, как разрушение опухолевых диссеминатов (очагов аномальных клеток), локализовавшихся на желудочных стенках, и уничтожение в прилегающих к злокачественному новообразованию лимфоузлах микрометастазов. Благодаря достижению этих целей специалисты быстро добиваются снижения биопотенциала опухоли и уменьшения её в размерах, а также предотвращает развитие такого вторичного патологического явления, как лимфома желудка.
Именно поэтому врачи очень большое внимание уделяют подбору необходимых доз и расчёту ритма воздействия радиационных лучей. Только правильно подобранный курс облучения рака желудка в предоперационный период даст видимые результаты. Общие назначения, которые применяются перед радикальным вмешательством, можно увидеть в таблице:
| ДНИ | 1-Я ФРАКЦИЯ | 2-Я ФРАКЦИЯ | СУТОЧНАЯ ДОЗА ОБЛУЧЕНИЯ | |
| Понедельник | 4 | 3 | 7 | Это примерный ритм облучения пред хирургическим вмешательством. Каждому конкретному пациенту дозировки ионизирующего излучения назначаются индивидуально. Обычно радикальная операция при раке желудка предваряется суммарной дозой 25 - 40 Гр |
| Вторник | 1,5 | 1,5 | 5 | |
| Среда | 1 | 1 | 2,5 | |
| Черверг | 1 | 1 | 2,5 | |
| Пятница | 1 | 1 | 2,5 | |
| Суббота | 1 | 1 | 2,5 | |
| Воскресенье | 1,5 | 1,5 | 5 |
Послеоперационная лучевая терапия при раке желудка
Комплекс ЛТ, проводимый перед оперативным вмешательством, является обязательной частью лечебного комплекса при разрастании в основном органе пищеварения злокачественного новообразования. В отличие от неё постоперационная терапия с помощью высокочастотного ионизирующего излучения не так востребована. Она менее эффективна и поэтому специалисты не всегда назначают данный курс.
Основными показаниями к её применению являются:
- повышенная вероятность интраоперационной диссеминации (проникновение во время операции мутировавших клеток в лимфо- и кровоток). Для того, чтобы избежать возникновения по этой причине рецидива болезни, пациентам назначается курс постоперационного облучения ложа, оставшегося после проведения резекции;
- опасности возникновения процесса метастазирования после недостаточного объема оперативного воздействия, проводимого по правилам абластики (удаление основного очага аномальных тканей совместно с находящимися в непосредственной близости лимфатическими сосудами и узлами).
Схемы облучения в каждом из этих случаев подбираются индивидуально для каждого пациента на основании результатов постоперационного диагностического исследования и действенности лечения остаточных опухолевых явлений сильнодействующими медикаментозными препаратами. Эффективность ЛТ после того, как проведена послеоперационная химиотерапия при раке желудка, напрямую зависит от того, на какой стадии находился онкопроцесс, в какой части пищеварительного органа была локализована злокачественная опухоль и результативности проведённой операции.
Интраоперационная лучевая терапия при раке желудка
В клинической практике ведущими онкологами отмечается такая проблема ЛТ, как невозможность подвести высокую дозу радиационного облучения непосредственно к разрушаемым злокачественным процессом тканям не повреждая при этом здоровые структуры. Для её решения разработано несколько подходов. Основным из них считается методика ИОЛТ - интраоперационной лучевой терапии.
Она заключается в том, что врач во время проведения хирургического вмешательства однократно обрабатывает поражённые раковой опухолью ткани большой дозой высокочастотного изотопного излучения.
Хотя данный метод лечения и проходит практически без осложнений, он имеет ряд специфических недостатков:
- для его применения требуется размещение в операционной дополнительного оборудования;
- при использовании этого метода невозможно избежать неблагоприятного воздействия на находящиеся в непосредственной близости от злокачественного образования здоровые структуры высокой дозы облучения;
- на успех процедуры влияет обязательное присутствие в операционном блоке онкорадиолога – узкопрофильного специалиста, занимающегося радиационной терапией;
- во время проведения высокодозного облучения пациента весь медицинский персонал, задействованный в операции, должен быть облачён в защитную одежду, препятствующую проникновению высокочастотных лучей.
Но эти недостатки ИОЛТ не являются препятствием к применению в лечебных целях данной методики, так как её эффективность и наличие у основной массы пациентов высокой результативности делают данный инновационный метод радиационного воздействия при злокачественных опухолях основного пищеварительного органа незаменимым. Хотя стоит отметить, что, несмотря на это, проводимая во время операции лучевая терапия при раке желудка большинству лечебных учреждений пока не доступна.
Это связано с тем, что в настоящее время отсутствует серийное производство линейных ускорителей, являющихся специализированными аппаратами для проведения ИОЛТ. Помимо этого на недоступность массового применения данной высокоэффективной технологии большое влияние оказывается значительными материальными затратами, необходимыми для регулярного использования в протоколах лечения данной терапевтической методики, а также удалённостью от операционных блоков пультовых подразделений и каньонов.
Полезна ли лучевая терапия при раке желудка?
ЛТ, применяемая с целью уничтожения аномальных тканевых структур, направлена на разрушение составляющих их клеток. Возможность радиационных лучей уничтожать мутировавшие клетки связана с тем, что ионизирующее излучение при взаимодействии с внутритканевой жидкостью провоцирует распад её на свободные радикалы, отрывающие электроны у аномальных микрочастиц, и пероксид. В результате этого аномальные клетки во время облучения быстро разрушаются. Такое воздействие радиации на злокачественные опухоли возможно на любой стадии рака желудка, поэтому польза ЛТ при этой патологии очевидна.
Данный метод, считается очень эффективным при большинстве недоброкачественных новообразований, но в случае с патологией основного пищеварительного органа применяется не всегда. Этому есть простое объяснение. Когда при помощи ионизирующего облучения лечат рак желудка, польза данного терапевтического воздействия зачастую оказывает намного меньше вреда, наносимого организму человека. Связано это с рисками поражения расположенных рядом внутренних органов и способностью желудочной слизистой привыкать к радиационным лучам, из-за чего их дозу требуется увеличивать. Именно поэтому решение о назначении курса ЛТ принимается специалистом после тщательного взвешивания всех «за» и «против».
Как и когда применяют лучевую терапию при раке желудка?
В случае наличия в желудке человека злокачественного новообразования, ЛТ нередко применяют с палиативной целью, для снижения проявлений негативной симптоматики. Обычно назначение облучения такого характера проводится в том случае, если у человека выявляется аденокарцинома желудка.
Применение данной методики хотя и не разрушает новообразование такого типа, но эффективно для устранения острого болевого синдрома и других негативных и опасных проявлений недуга. Благодаря этому происходит значительное повышение качества жизни пациента.
Также применение ЛТ требуется в следующих случаях:
- перед хирургическим вмешательством. Правильно назначенный курс ионизирующего излучения способствует уменьшению новообразования в размерах, чем облегчает проведение операции;
- после оперативного вмешательства. Здесь применение данного метода обусловлено необходимостью разрушить оставшиеся аномальные клетки;
- для купирования процесса развития рецидива болезни.
Важно! В каждом конкретном случае необходим подбор специалистом индивидуального курса ЛТ. Для этого в расчёт берутся такие показатели, как возрастная категория и общее состояние здоровья пациента, наличие негативной симптоматики, а также тип и стадия развития злокачественного новообразования.
Подготовка к лучевой терапии
Обычно перед тем, как начинать курс воздействия на злокачественное новообразование радиационным излучением, необходимо подготовить к нему пациента. Подготовительный этап состоит из нескольких достаточно важных аспектов. Основой его является коррекция питания. За 10 дней до начала процедур необходимо начать соблюдать диету, в которой под полным запретом оказываются маринованная, острая, копчёная и жирная пища. Категорически недопустимо употребление спиртных напитков.
Также человеку за неделю до ЛТ стоит заняться дыхательной гимнастикой, увеличить время для сна и провести санацию рта. Также в подготовительные мероприятия входит приобретение некоторых вещей, необходимых во время проведения курса лечения.
Перечень их можно посмотреть в таблице:
| ЧТО ПОТРЕБУЕТСЯ ВО ВРЕМЯ ПРОВЕДЕНИЯ КУРСА ЛТ? | ДЛЯ ЧЕГО ЭТО НЕОБХОДИМО? |
| Наличие хлопчатобумажной одежды с минимумом швов | Весь период воздействия на организм ионизирующего излучения необходимо носить такую одежду, так как это обеспечит меньшее травмирование облучённой кожи |
| Приобретение трав с обеззараживающим и вяжущим действием – коры дуба, шалфея, ромашки | Шестиразовое ежедневное полоскание отварами этих растений ротовой полости и горла поможет снизить негативное влияние радиации |
| Замена зубной щётки и пасты | Защиту полости рта от возможных повреждений можно обеспечить только осторожной чистки зубов при помощи достаточно мягкой щётки маленьких размеров и гелевых зубных паст с фтором |
Процесс подготовки пациента к лучевому лечению предусматривает и проведение определённых диагностических мероприятий. Они необходимы для уточнения размеров и места локализации опухоли. Полученные результаты исследования помогут радиологу определиться с оптимальной для каждого конкретного пациента дозой облучения и углом подачи высокочастотного излучения.
Когда лучевая терапия при раке противопоказана?
ЛТ, особенно проводимая совместно с лечением сильнодействующими лекарственными препаратами, способна нанести организму непоправимый вред. Эта её негативная особенность является основным фактором, учитываемым во время назначений. Обычно количество пациентов, допускаемых к такой разновидности терапии, ограничивается некоторыми показателями.
Основными противопоказаниями для проведения лечебных сеансов с помощью этого метода, являются:
- тяжелые декомпенсированные заболевания (хронические патологии, протекающие в тяжёлой форме с частыми периодами обострений) почек, печени, дыхательной и сердечно-сосудистой систем;
- раковая кахексия – проблемы в работе большинства внутренних органов и сильное истощение, спровоцированные прогрессирующим развитием злокачественного образования;
- острая или хроническая форма лучевой болезни, возникшие вследствие получения пациентом на протяжении какого-то времени повышенной дозы изоляции;
- нарушения психики;
- туберкулёз.
Важно! По причине имеющихся при данной методике лечения противопоказаний, перед её назначением необходимо прохождение не только специализированной диагностики, выявляющей форму и размеры развивающейся опухоли, но и консультация специалистов, занимающихся терапией других патологий внутренних органов, а также нервной и кровеносной систем.
Осложнения после лучевой терапии при раке желудка
Побочные последствия воздействия ионизирующего радиационного излучения напрямую связаны с такими факторами, как его разновидность, глубина проникновения в тканевые структуры, индивидуальные реакции организма человека. Чем длительнее период лучевого воздействия и выше частотность применяемых для него лучей, тем ощутимее окажется реакция пациента. Чаще всего осложнения после лучевой терапии отмечаются у тех онкобольных, которым был назначен длительный курс терапии. У каждого человека своя реакция организма на воздействие радиационных лучей. У кого-то она может быть достаточно явной, а кто-то просто не заметит появления побочных эффектов.
Среди основных осложнений, способных возникнуть в ходе ЛТ, специалисты выделяют следующие:
- появление в месте воздействия ярко выраженной отёчности и болезненности;
- необъяснимый упадок сил и постоянное ощущение усталости;
- патологические реакции со стороны слизистых оболочек, к примеру, развитие стоматита или образование папиллом;
- непрекращающиеся кашель и одышка;
- постоянное чувство жажды и голода;
- повреждение в месте облучения кожных покровов (появление на них ожога, сходного с солнечным);
- алопеция, сильное выпадение волос.
Не всегда осложнения ЛТ протекают в тяжёлой форме. Некоторые люди, проходящие такие курсы лечения, их практически не замечают. Также и время проявления негативных последствий нельзя считать однозначным. В некоторых случаях побочные эффекты появляются сразу же после проведённого сеанса, а в других они могут проявиться только лишь после выписки больного из стационара.
Кибер нож при раке желудка: противопоказания и подготовка
Эта система даёт специалистам возможность удалять злокачественные новообразования и метастазы даже в самых труднодоступных местах. Для такого лечения применяются радиационные лучи. Точность попадания на поражённую область фотонов, выпускаемых аппаратом, очень высокая, что позволяет «выжигать» непосредственно саму опухоль, не подвергая радиационному разрушению здоровые структуры, находящиеся в непосредственной близости.
Если онколог решил использовать кибер-нож при лечении рака желудка, необходимо проведение некоторых мероприятий, которые сделают процедуру более эффективной и полностью безопасной для человека. Основные стадии подготовки к лечебному курсу можно посмотреть в расположенной ниже таблице:
| ЭТАПЫ ПОДГОТОВКИ | ТЕХНИКА ПРОВЕДЕНИЯ |
| Установка меток | В опухоль или близко от неё помещаются золотые имплантаты, служащие ориентиром для точного направления радиационного луча. Процедура выполняется амбулаторно и после её окончания человека отпускают домой |
| Создание иммобилизатора | Каждому пациенту изготавливается специальный костюм из пластика, который должен быть достаточно комфортабельным, ведь человеку придётся находиться в нём длительный период времени. Он необходим для того, чтобы исключить случайные движения |
| Составление лечебного плана | На этом этапе проводятся безболезненные диагностические процедуры КТ, МРТ или ПЭТ. С их помощью определяется место расположения опухоли, её форма и размеры |
| Настройка аппарата | По снимкам, полученным на предыдущем этапе, кибер-нож программируется. Процесс подготовки системы заключается в закладывании в него сведений об опухоли: месторасположения и взаимосвязи со здоровыми структурами, формы, размеров. Помимо этого специалист рассчитывает оптимальную дозу облучения |
Стоит отметить, что применение кибер ножа при раке желудка применяется не всегда. У данной малоинвазивной процедуры, имеющей высокую эффективность, отмечается наличие определённых противопоказаний.
К ним относятся:
- обширные, находящиеся в стадии постоянной регрессии опухоли, способные привести к радионекрозу, что является прямой угрозой жизни человека;
- крупные новообразования, в результате выжигания которых возможно образование свища.
Эти противопоказания являются абсолютными, то есть их наличие делает операцию при помощи системы Кибер-Нож категорически недопустимой. Также специалистами отмечаются относительные, которые в случае возникновения жизненной необходимости применения такой разновидности терапии, можно отменить. К таким противопоказаниям относятся обширное метастазирование в основном органе пищеварения, обострение имеющихся в анамнезе болезней, психические расстройства, плохие анализы крови человека и его тяжёлое общее состояние.
Кибер нож: процесс проведения лечения при раке желудка
Методика применения в лечебных мероприятиях этого высокочувствительного аппарата основана на имеющихся у радиационного излучения возможностях быстро вызывать разрушение аномальных клеточных структур. Эффект от проведённой процедуры сопоставим с воздействием скальпеля, только без допущения травмирования кожных покровов и мышечных тканей.
Основные стадии терапии с применением системы кибер нож при раке желудка:
- онкобольному проводят рентген, необходимый для ориентации в правильном положении линейного ускорителя;
- пациент облачается в удобную хлопчатобумажную одежду без швов для предупреждения возможного травмирования во время облучения кожных покровов;
- на голову человека одевается специальная маска, защищающая от лучей радиации;
- пациента кладут на стол и подключают аппарат, манипулятор которого будет двигаться вокруг его тела, периодически останавливаясь в заданных точках для проведения непосредственно облучения.
Один сеанс ЛТ при помощи Кибер-ножа длится от получаса до двух часов. Спустя день после проведённой процедуры человек возвращается в клинику для проведения контрольных замеров. Они позволяют выяснить результативность выполненного лечения. Для наиболее точного контроля применяют такие методы диагностического исследования, как МРТ и КТ.
Используя систему кибер-нож для лечении рака желудка опытный специалист может не только достигнуть высокой результативности процедуры, но и обеспечить пациенту высокую комфортность во время проведения процедуры. Преимущества терапевтических мероприятий с помощью этого аппарата заключаются для человека в отсутствии болевого синдрома и разрезов, оставляющих шрамы. Также такое лечение проводится без наркоза, пациент за короткое время восстанавливается вне стационара и может быстро вернуться к привычному образу жизни.
Последствия
Лучевая терапия, хотя и считается одним из самых эффективных методов воздействия на раковые опухоли, всё же может представлять для некоторых пациентов повышенную опасность. Связано это с возможными последствиями такой разновидности лечения. Они связаны с негативным воздействием радиации на располагающиеся в непосредственной близости от злокачественного новообразования здоровые ткани.
Специалистами отмечаются следующие общие последствия лучевой терапии:
- патологическое воздействие на кровь. Оно связано с возможностью радиоактивного излучения ухудшать в костном мозге функцию продуцирования кровяных клеток. Следствием этого становится развитие нейтропении или анемии;
- повышенная утомляемость и постоянная усталость. Они появляются из-за того, что организм человека направляет свои основные силы на борьбу с повреждениями, вызываемыми воздействием ЛТ на здоровые клетки.
Данные негативные проявления обычно возрастают по ходу проведения сеансов ЛТ. Для того, чтобы снизить их негативное влияние на организм, специалисты рекомендуют во время проведения курса облучения чаще бывать на свежем воздухе и правильно питаться. Все индивидуальные рекомендации, помогающие справиться с тяжёлыми последствиями терапевтических мероприятий с помощью радиоизотопного излучения, каждому пациенту озвучивает лечащий врач при назначении курса.
Радиохирургия при раке желудка
Данная процедура, проводимая с помощью изотопного излучения, является одной из составляющих ЛТ. Основной её особенностью является направление пучка изотопов непосредственно на саму опухоль, минуя мышечную ткань. Используется радиохирургия при раке желудка или во время проведения традиционного оперативного вмешательства по удалению опухоли, или фотоны доставляются к ней при помощи как постоянно имплантированных, так и временно подведённых капсул, катетеров или игл. Благодаря данному методу обеспечивается настолько точное влияние изотопов на поражённые аномальным процессом ткани, что практически никогда не отмечается возникновения каких-либо осложнений и побочных эффектов.
В клинической онкологии существует определённый ряд показаний к проведению данной разновидности лучевого воздействия:
- расположение опухоли в труднодоступном месте;
- отказ пациента от проведения традиционного хирургического вмешательства;
- наличие в области основного пищеварительного органа метастаз.
Сам метод такого воздействия заключается в следующем. В то время, когда вскрывается при проведении радикальной операции брюшная полость, к культе основного пищеварительного органа, на сантиметр выше анастамоза, крепится кетгутовыми швами резиновая трубка минимального диаметра. Вторую такую же трубку располагают в клетчатке забрюшинной области. Они предназначены для выполнения двух ролей – во-первых, служат постоперационным дренажом, а во-вторых через них подаётся радиоактивный кобальт, который повреждает ДНК поражённых клеток, вызывая их гибель.
Недостатки метода
Эта процедура имеет высокую эффективность и практически никогда не вызывает побочных эффектов, но всё-таки специалистами отмечаются некоторые ранние осложнения радиахирургии при раке желудка:
- появление немотивированной общей слабости, утомляемости и острых головных болей;
- отёк и раздражение кожного покрова с шелушением, зудом и пигментацией кожи в месте вывода трубки на поверхность;
- постоянное ощущение подташнивания, время от времени перемежающегося рвотными позывами;
- изредка возникающие судороги;
- нарушения стула.
После применения этого метода возникают и отдалённые последствия рудиохирургии. К ним относятся негативные изменения со стороны внутренних органов (почек, лёгких, прямой кишки, головного и спинного мозга). Их можно избежать только в том случае, когда было назначено и проведено оптимально адекватное лечение, в ходе которого не допускались погрешности, как со стороны доктора, так и пациента. Следует знать и о том, что, как химиотерапия, так и лучевая терапия не бывают самостоятельными методами. Они, как правило, являются дополнительной терапией, проводимой совместно с хирургическим воздействием.
Информативное видео
Сегодня около половины больных онкологичскими заболеваниями проходят лечение рака методом лучевой терапии. Это лечение, которое было разработано на рубеже 20-го века, использует силу излучения для уничтожения раковых клеток, пытаясь избежать вреда близлежащей здоровой ткани.
Лучевая терапия рака в Израиле прошла долгий путь с момента начала ее применения. Недавние успехи позволили врачам разработать более безопасный и быстрый метод,который называется гипофракционированной лучевой терапией, и это помогает врачам сократить курсы облучения почти вдвое, значительно сократив общее количество лучевой терапии,необходимой пациенту. Имея меньше сеансов лучевой терапии, можно улучшить качество жизни пациентов - меньшее количество сеансов лечения может означать меньшее количество неприятных побочных эффектов, таких как раздражение кожи, потеря аппетита, тошнота и усталость, которые часто связаны с лечением рака. Это также означает меньше поездок в онкологический центр.
Если вас интересует, сколько стоит лечение рака в Израиле, при этом интересна реальная сумма, а не маркетинговая уловка о снижении цен, свяжитесь с нами любым удобным способом. Мы оперативно выйдем на связь, ответив на поступившие в наш адрес вопросы
Узнать стоимость лечения
В некоторых случаях более высокая доза, получаемая при меньшем количестве сеансов, может быть более эффективным методом лечения рака.
В то время как обычная лучевая терапия доставляет пациенту небольшое количество радиации в течение девяти недель, гипофракционированная лучевая терапия доставляет большие дозы или фракции излучения часто примерно за пять недель, а иногда и всего за несколько дней. Стереотаксическая лучевая терапия (SBRT), точная, высокодозовая форма гипофракционированной лучевой терапии, позволяет врачам лечить рак всего от одного до пяти процедур.
Частично, быстрые лучевые процедуры эффективны, потому что передовая технология помогает физикам рассчитать правильную дозу облучения и точно позиционировать пациента для ее получения, так что лучи излучения нацелены только на опухоли. Цель состоит в том, чтобы оставить как можно больше здоровых окружающих клеток нетронутыми излучением.
Способность сохранять качество жизни пациента улучшается с каждым достижением в области радиационных технологий.
Достижения включают высокотехнологичное вычислительное программное обеспечение, технологию, которая помогает защитить соседние части тела от облучения и 4-D сканирования для планирования лечения. Эта способность лучше, чем это было пять лет назад, и большой прорыв за пределы того, что было доступно 10 лет назад
Однако быстрая лучевая терапия не является вариантом для всех пациентов или даже всех видов рака. Радиационные онкологи назначают гипофракционирование для пациентов, проходящих лечение рака предстательной железы, лечение рака желудочно-кишечного тракта, легких и молочной железы.
Лечение рака предстательной железы в Израиле
Время лечения: стандартное лечение рака предстательной железы в Израиле - это курс из 44 процедур, проведенных в течение девяти недель. При гипофракционированной лучевой терапии пациентам назначают пять процедур в течение двух недель.
Новые достижения: лучевая терапия является распространенным методом лечения рака предстательной железы. Однако, радиация может повредить прямую кишку, которая близка к предстательной железе. Важное значение имеет защита прямой кишки; если она повреждена, у человека может возникнуть недержание.
Новые технологии «открыли дверь» для безопасного и быстрого лечения рака предстательной железы. Одна из них, SpaceOAR,которая по существу является гель-спейсером, который помогает удерживать прямую кишку от предстательной железы во время лучевой терапии. Это создает еще один уровень безопасности - можно размещать жидкость между простатой и прямой кишкой, эффективно защищая прямую кишку от очень высоких доз радиации.
Врачи Израиля также используют передовые технологии для отслеживания естественного движения предстательной железы во время лучевой терапии. Это 4-D система слежения, в которой используются микро-размерные транспондеры, которые имплантируются в простату урологом во время быстрой амбулаторной процедуры. Если простата двигается во время лечения, транспондеры "бьют тревогу", которая предупреждает команду радиационной онкологии. Лечение автоматически прекращается до тех пор, пока технические специалисты не сделают необходимые корректировки, чтобы защитить области вокруг простаты, особенно прямой кишки и мочевого пузыря.
Совмещение передовой технологии SpaceOAR и радиочастотного отслеживания, позволяет с высокой степенью защиты проводить SBRT простаты.
Получить программу лечения
Кому подходит: быстрая лучевая терапия(гипофракционированная лучевая терапия) подходит большинству больных,проходящих лечение рака простаты в Израиле. Исключения составляют мужчины с тяжелыми симптомами мочи (более быстрое лечение имеет несколько более высокие краткосрочные побочные эффекты на оргабы мочеиспускания, например, воспаление и обструкция мочевого пузыря). Кроме того, этот метод не используется для мужчин, которым необходима терапия лишения андрогенов (гормональная терапия, которая подавляет тестостерон), или которым необходимо излучение для региональных лимфатических узлов.
Лечение рака ЖКТ в Израиле
Время обработки: Рак желудочно-кишечного тракта возникает в пищеводе, желудке, желчной системе, поджелудочной железе, тонком кишечнике, толстой кишке, прямой кишке и анусе. Проходя лечение рака желудка в Израиле или лечение рака кишечника в Израиле методом стандартной лучевой терапии пациенты получают лечение пять дней в неделю в течение примерно шести недель. Однако SBRT уменьшает количество обработок до пяти,высокой дозы. Этот более быстрый подход к лечению рака ЖКТ в Израиле также устраняет необходимость в одновременной химиотерапии.
Новые достижения: использование четырехмерной компьютернож томографии для планирования лечения - по существу видео, показывающее движение опухоли по мере того, как пациент дышит, эти 4-мерные планировочные КТ-сканы позволяют фокусировать поле излучения на точной области, которую занимают опухоли во время дыхательного цикла. Также используются технологии для ограничения движения опухоли от дыхания и для отслеживания движения опухолей во время лечения.
Кому подходит: для пациентов, которые не получают химиотерапию, SBRT является вариантом лечения рака ЖКТ в Израиле в случаях, когда нет рака поджелудочной железы или он может быть частично удален во время операции, или для пациентов, которые не могут провести операцию по другим медицинским причинам. Это также вариант для пациентов с повторной опухолью в той же области после операции. SBRT также используется у пациентов с первичными опухолями печени (такими как гепатоцеллюлярная карцинома и холангиокарциномы) и для пациентов с ограниченным числом метастазов в печени.
Подать заявку на лечение
Лечение рака легкого в Израиле
Время лечения: на ранней стадии лечение рака легких в Израиле методом стандартной лучевой терапии представляет собой около семи недель облучения. Это время может быть сокращено до трех-пяти процедур в течение двух недель, и пациентов с прогрессирующим раком, которые не метастазируются, можно лечить примерно за четыре недели.
Новые достижения: использование высокоточной технологии визуализации, позволяет более точно нацелить излучение на опухоли,что позволяет доставить более высокие дозы облучения при более коротком числе курсов.
Кому подходит: пациенты с раком, ограниченным грудным отделом, которые не собираются принимать химиотерапию, могут быть кандидатами на гипофракционную лучевую терапию.
Лечение рака молочной железы
Время лечения: для ранней стадии стандартное лечение рака молочной железы в Израиле состоит либо из мастэктомии, либо для консервации груди (также известной как операция по сохранению груди или лумпэктомия), за которой следует пять-семь недель облучения груди. Для некоторых пациентов сейчас рекомендуется гипофракционная лучевая терапия. Побочные эффекты лечения с более коротким курсом также эквивалентны, если не лучше стандартного лечения.
Записаться на лечение
Курс лечения гипофракционированной лучевой терапии рака молочной железы состоит в том, чтобы доставлять несколько большую суточную дозу облучения пять дней в неделю, причем около 15 фракций в течение четырех недель вместо 33 фракций в течение семи недель. «В конечном счете, общая доза, получаемая при гипофракционированной терапии, эквивалентна и дает аналогичные результаты и побочные эффекты.
Новые достижения: технология под названием Deep Inspiration Breath-Hold (DIBH) делает грудную радиотерапию более безопасной для пациентов с левосторонним раком молочной железы, уменьшая воздействие радиации на сердце. Когда излучение нацелено на всю грудь или стенку грудной клетки, луч излучения разрушает всю ткань, с которой он контактирует. У левосторонних пациентов с раком молочной железы части сердца и легкие, расположенные под грудной клеткой, иногда подвергаются воздействию луча излучения. При использовании метода DIBH излучение подается только тогда, когда пациент делает глубокий вдох, и в точном положении, которое расширяет грудную клетку и безопасно перемещает сердце вне зоны воздействия пучка излучения.
Кому подходит: гипофракционированное облучение груди является рекомендуемым методом лечения для избранной группы пациентов с ранним раком молочной железы.
Благодаря гипофракционированной лучевой терапии лечение рака становится все более быстрым и легким для пациентов с раком предстательной железы, желудочно-кишечного тракта, легких и молочной железы. И в настоящее время проводятся клинические испытания, чтобы определить, будет ли более быстрое время лечения эффективно лечить другие виды рака.
ТКАЧЁВ С. И., МЕДВЕДЕВ С. В., РОМАНОВ Д. С., БУЛЫЧКИН П. В, ЮРЬЕВА Т. В., ГУТНИК Р. А., ЯЖГУНОВИЧ И. П., БЕРДНИК А. В., БЫКОВА Ю. Б.
Появление инновационных технических разработок: трёхмерного планирования, использование многолепесткового коллиматора, моделированной по интенсивности лучевой терапии, более совершенных методов фиксации -значительно повысили возможности точного подведения и эскалации дозы ионизирующего излучения к выбранному объёму. Это изменило представление о роли лучевой терапии в лечении метастатического поражения печени. Данные зарубежных авторов свидетельствуют о возможности достижения 95% локального контроля через год после проведения стереотаксической радиотерапии, 92% - через два года (и 100% для опухолей размерами менее 3 см.) при развитии лучевых повреждений третьей и выше степени всего в 2% случаев. В 2011 году, после технического перевооружения ФГБУ РОНЦ им. Н. Н. Блохина РАМН, в клинической практике для лечения больных с метастатическим поражением печени стала внедряться методика локальной стереотакси-ческой радиохирургии (SBRS). Методика позволяет создать локально в метастатическом опухолевом узле высокую дозу ионизирующего излучения и вызвать разрушение опухоли. Это перспективное направление в лечении метастатического рака печени значительно расширило возможности комбинированного лечения. В статье приведен обзор литературы по лечению метастатического поражения печени, также мы публикуем результаты использования стереотаксической радиохирургии у тридцати пяти пациентов с метастатическим поражением печени и клинический случай успешного применения данной методики у соматически отягощенной пациентки.
Ключевые слова: метастатическое поражение печени, стереотаксическая радиохирургия, локальный контроль.
Контактная информация:
С. И. Ткачёв, С. В. Медведев, Д. С. Романов, П. В. Булычкин, Т. В. Юрьева, Р. А. Гутник, И. П. Яжгунович, А. В. Бердник, Ю. Б. Быкова - Радиологическое отделение, отдела радиационной онкологии (зав. - проф. С. И. Ткачёв) ФГБУ РОНЦ им. Н. Н. Блохина, РАМН, Москва. Для корреспонденции: Романов Денис Сергеевич, [email protected]
Введение
При проведении аутопсии метастатические очаги в печени обнаруживаются у 30% больных онкологическими заболеваниями. Для лечения пациентов с множественным метастатическим поражением печени (более трех очагов) предпочтительна системная и/или регионарная лекарственная терапия. У пациентов с ограниченным поражением печени возможно применение локальных методов лечения, таких как: хирургическая резекция, радиочастотная термоабляция, химиоэмболизация, радиоэм-болизация, криодеструкция, введение этанола,
микроволновая коагуляция, лазерная термодеструкция, электролиз метастазов. У каждого из этих подходов есть свои преимущества и недостатки, но только стереотаксическая лучевая терапия может применяться в случае наличия противопоказаний для применения вышеперечисленных методик .
Долгое время лучевая терапия считалась малоперспективной методикой для лечения метастатического поражения печени. Применение такой методики, как тотальное облучение печени не зарекомендовало себя эффективной и безопасной, как, например, облучение всего головного мозга в случае метастатического по-
OF MALIGNANT TUMOURS
ражения данного органа. С совершенствованием научно-технологической базы лучевой терапии: появлением новых технологий подведения дозы ионизирующего излучения, систем планирования, верификации планов дистанционной лучевой терапии, визуализации, фиксации пациентов, развитием радиобиологии - радиационные онкологи получили грозное оружие в борьбе с метастатическим поражением печени - стереотаксическую радиохирургию новообразований указанного органа.
Стереотаксическая радиохирургия
В 90-х годах прошлого столетия в зарубежной литературе появились первые работы о целесообразности проведения локальной стерео-таксической радиохирургии (stereotactic body radiation surgery - SBRS) при единичных (до 3 очагов) метастазах в печень .
В связи с биологическими особенностями метастатического поражения печени при раке толстой кишки, больные этой группы выделены в отдельную подгруппу. Золотым стандартом локального лечения метастазов в печени, в частности, метастазов колоректального рака, является резекция печени. Несколько крупных исследований демонстрируют пятидесятипроцентную общую выживаемость через пять лет после проведения операции . Исторически считалось возможным проведение резекции печени в тех ситуациях, когда возможно полное удаление ограниченного количества метастазов с негативным краем резекции более одного сантиметра и остающимся после операции объёмом печени, достаточным для адекватного функционирования органа (не менее 30% от всего функционального объёма печени). При следовании этим критериям проведение резекции возможно у 30-40% пациентов, в ней нуждающихся. На данный момент возможно одновременное удаление более семи метастазов из печени, установлено, что ширина негативного края резекции не влияет на локальный контроль и выживаемость пациента . В крупных центрах, занимающихся данной проблемой риск послеоперационных осложнений и смертности сведён к минимальным значениям. Более того, повторные резекции при реци-дивировании рака в печени вполне безопасны
и дают такие же преимущества в выживаемости, как и резекция, выполненная в первый раз . К сожалению, пациенты с синхронными билобарными, крупными, локализованными в неудобных для проведения оперативного вмешательства метастазами и внепечёночны-ми проявлениями болезни, те, у кого резекция не оставит необходимых 30% печени, пациенты старше семидесяти лет и отягощённые соматически, часто признаются нерезектабельными, а следуя данной логике, некурабельными. Кроме того, не существует рандомизированных исследований, в которых бы сравнивался эффект после резекции, в сравнении с консервативными нехирургическими методами локальной терапии, у операбельных больных.
Появление инновационных технических разработок (трёхмерное планирование, многолепестковый коллиматор, лучевая терапия с моделированием интенсивности (intensity modulated radiation therapy, IMRT), более совершенные методы фиксации), значительно повысивших возможность точного подведения ионизирующего излучения к выбранному объёму, а следовательно, и подведения более высокой дозы к объёму опухоли, изменили представление о роли лучевой терапии в лечении метастатического поражения печени. Вариант высокоточной лучевой терапии, при которой аблативная доза подводится за 1-5 фракций называется стереотаксической радиотерапией. В случае экстракраниального использования данный вид лучевой терапии называется стереотаксической лучевой хирургией тела (stereotactic body radiation surgery - SBRS). В соответствии с определением, данным ASTRO, SBRS предполагает подведение больших доз ионизирующего излучения с высокой конформностью и резким градиентом дозы в окружающих нормальных тканях за небольшое число фракций (от двух до шести) к опухолям, располагающимся за пределами головного мозга .
Существует немало публикаций, касающихся применения SBRS для лечения злокачественных поражений печени, которые демонстрируют обнадёживающие результаты. Самые ранние из них относятся к 1994-1995 годам . В этой работе исследователи сообщают о первых результатах проведения SBRT 42 экстракраниальных опухолей
у 31 пациента. 23 пациента были подвергнуты лучевой терапии по поводу метастазов в печени (14 пациентов) или гепатоцеллюляр-ной карциномы (9 пациентов). Большинство больных имели одиночные опухоли в печени, лёгких и забрюшинном пространстве. Их объёмы субклинического распространения опухоли (CTV - clinical target volume,) варьировались от 2 до 622 см3 (со средним значением 78 см3), а разовые очаговые дозы (РОД) находились в диапазоне от 7,7 до 30 Гр за фракцию (со средним значением в 14,2 Гр), подводились за 1-4 фракции. Исследователи отмечали локальный контроль в 80% случаев в течение последующей жизни пациентов, продлившейся от 1,5 до 38 месяцев. Кроме того, было отмечено исчезновение или уменьшение опухолей в размерах в пятидесяти процентах случаев . Медиана периода наблюдения за пациентами составила 10 месяцев для пациентов с ге-патоцеллюлярной карциномой (значения от 1 до 38 месяцев) и 9 месяцев для пациентов с метастатическим поражением печени (значения от 1,5 до 23 месяцев).
В 1998 году та же исследовательская группа сообщила об опыте применения стереотакси-ческой радиохирургии для лечения первичных злокачественных и метастатических опухолей печени, СОД составила от 15 до 45 Гр, подведённых за 1-5 фракций. Были пролечены пятьдесят пациентов с 75 опухолями. Пролеченные объёмы варьировались от 2 до 732 см3 (со средним значением в 73 см3). В течение последующего наблюдения со средним значением в 12 месяцев (значения находились в интервале от 1,5 до 38 месяцев), примерно в 30% случаев была зафиксирована стабилизация процесса, около 40% опухолей уменьшились в размерах и 32% полностью регрессировали. Четыре (5,3%) опухоли были интерпретированы как локальные неудачи . К сожалению, средняя продолжительность жизни составила только 13,4 месяца (со значениями от 1,5 до 39 месяцев) с преобладанием причин смерти от прогрессирующего цирроза печени или внепечёночного про-грессирования основного заболевания.
дозами 20 Гр (две фракции) или 15 Гр (три фракции). В сроки наблюдения от 13 до 101 месяца был достигнут локальный контроль над всеми рецидивными опухолями с полной регрессией метастазов в двух случаях. Только у одного пациента произошло местное прогрессирование заболевания в виде поражения двух долей органа, которому предшествовало внепечёночное распространение болезни. Один пациент впоследствии умер от неонкологических причин при отсутствии признаков основного заболевания, двое умерли от генерализации злокачественного процесса, а один пациент на момент окончания исследования пребывал в ремиссии уже в течение 101 месяца после проведения стереотаксической радиохирургии.
Dawson et al. провели SBRT 16 пациентам с печеночными метастазами и 27 пациентам с первичной гепатоцеллюлярной карциномой, используя 3D-конформную лучевую терапию, в средней дозе 58,5 Гр (от 28,5 до 90 Гр) по 1,5 Гр за фракцию дважды в день. Был отмечен один случай развития RILD III степени и не было отмечено ни одного случая смерти, связанного с проводимым лечением. В более позднем исследовании Dawson et al. cмоделировали возможность развития осложнений со стороны нормальных тканей для развития RILD в течение 4 месяцев после проведения конформной лучевой терапии по поводу метастатического поражения печени или внутрипечёночных гепатобилиарных опухолей. Исследование продемонстрировало значительное влияние величины объёма и средней разовой очаговой дозы на прогнозирование развития RILD в многовариантных анализах. Другими значимыми предрасполагающими факторами развития RILD были первичные заболевания печени (холангиокарци-нома и печёночноклеточный рак по сравнению с метастатическим поражением) и мужской пол. Было отмечено, что эти пациенты также получали одновременную местную химиотерапию и использование бромдеоксиуридина (в сравнении с флюородеоксиуридином) также было связано с повышенным риском развития RILD. Не было случаев развития RILD при подведении к печени средней суммарной очаговой дозы менее 31 Гр.
В 2001 году Herfarth et al. провели исследование, в котором изучалась эффек-
Возможности стереотаксической радиохирургии при лечении больных с метастатическим поражением печени
тивность применения SBRS у 37 пациентов с 60 очагами в печени. Поглощенная доза составила 26 Гр, а размер опухолей варьировался от 1 до 132 см3 со средним значением в 10 см3. Все пациенты хорошо перенесли лечение, SBRS не привело ни к одному случаю развития значительных побочных эффектов. Одиннадцать пациентов в период от одной до трёх недель по окончании лечения отметили периодическое снижение аппетита или умеренную тошноту. Ни у одного из прошедших лечение пациентов не развилась клинически обнаруживаемая радиоиндуцированная болезнь печени. В результате SBRS в течение 5,7 месяцев (варьировался от 1 до 26,1 месяцев) в пятидесяти четырех из пятидесяти пяти (98%) опухолей наблюдался положительный эффект, по данным компьютерной томографии, проведённой через 6 недель (22 случая стабилизации заболевания, 28 случаев частичного ответа и 4 случая полного ответа). Локальный положительный эффект составил 81% в течение 18 месяцев по окончании лечения.
Wulf et al. сообщили о результатах проведения SBRS пяти пациентам с первичным раком печени и 39 больным с 51 печёночным метастазом, выполненного в Вурцбургском Университете. Двадцать восемь опухолей были отнесены в состав так называемой группы «низкой дозы» трёмя фракциями по 10 Гр (27 пациентов) или четырьмя сеансами по 7 Гр (1 больной). Кроме того, существовала так называемая группа «высокой дозы», входящие в состав которой пациенты были подвергнуты SBRS с разовыми дозами 12-12,5 Гр с тремя фракциями (19 больных) или 26 Гр за одну фракцию (9 пациентов). Медиана наблюдения составила 15 месяцев (от 2 до 48 месяцев) для первичного рака печени и 15 месяцев (от 2 до 85 месяцев) у пациентов с метастатическим поражением печени. Во всех случаях первичного злокачественного заболевания печени был достигнут положительный эффект, включая истинную стабилизацию. Среди пятидесяти одного метастаза было отмечено 9 случаев местного ре-цидивирования в сроки от трёх до 19 месяцев. Была отмечена разграничивающая значительная корреляция между суммарной дозой радиации и показателями локального контроля (р=0,077) с показателями локального контроля на уровне 86% и 58% через 12 и 24 месяца
в группе «низкой дозы» против 100% и 82% в группе «высокой дозы» соответственно. Не было выявлено ни одного случая развития лучевых повреждений III или выше степеней RTOG-EORTC. В многовариантном анализе противопоставление высокой дозы малой было единственным значимым фактором прогнозирования показателей локального контроля (р=0,0089). Общая выживаемость через один и два года среди всех пациентов составила 72% и 32% соответственно. Авторы дают заключение о том, что SBRS первичных злокачественных заболеваний и метастатических опухолей печени является эффективным местным методом лечения без значительных осложнений для пациентов, которым было отказано в оперативном вмешательстве.
В исследовании Hoyer et al. , приводятся результаты применения SBRS в лечении метастазов колоректального рака. Шестьдесят четыре пациента с суммарными 141 метастазом колоректального рака в печени (44 больных) или лёгких (20 больных) были подвергнуты SBRS тремя фракциями по 15 Гр в течение от пяти до восьми дней. Медиана наблюдения составила 4,3 года, а после двух лет показатели локального контроля составили 86%. Лучевая токсичность в большинстве случаев была умеренной, однако, было зафиксировано три случая серьёзных неблагоприятных событий и один смертельный случай. Исследователи сделали вывод, что SBRS для неоперабельных метастазах колоректального рака не уступает другим методами локальной абляции метастазов.
Несколько позднее Schefter et al. сообщили предварительные результаты многоцентрового исследования I фазы применения SBRS у больных с метастазами в печень. Пациенты имели от одного до трёх метастазов в печени, с максимальным диаметром опухоли менее шести сантиметров и адекватную функцию печени. Часть пациентов были подвергнуты SBRS в суммарной дозе 36 Гр за три фракции. Другая часть больных получили более высокие дозы радиации вплоть до 60 Гр за три фракции. По меньшей мерее 700 миллилитров здоровой ткани печени должно было получить суммарную дозу менее 15 Гр. Дозолимитирующей токсичностью были избраны проявления острых лучевых повреждений печени или кишечника III степени или любые проявления острых лучевых повреж-
дений IV степени. Ни у одного пациента не было выявлено дозолимитирующих лучевых повреждений, таким образом, доза радиации была поднята до 60 Гр за три фракции. Двенадцать из 18 пациентов были живы на момент проведения анализа исследователями с медианой в 7,1 месяц после включения их в протокол.
Исследование было продолжено и в 2006 году Kavanagh et al. сообщили о результатах анализа I/II фаз проспективного исследования применения SBRS для лечения метастатического поражения печени. В данном случае в исследование включались пациенты не более чем с тремя опухолями с максимальным диаметром менее шести сантиметров. Суммарная очаговая доза составила 60 Гр за три фракции в течение от трёх до четырнадцати дней. В 2006 году были опубликованы промежуточные результаты применения SBRS у 36 пациентов: 18 из первой фазы и 18 из фазы второй. Среди 21 пациента с периодом наблюдения, варьировавшим от шести до 29 месяцев, был отмечен всего лишь один случай развития лучевых повреждений третьей степени RTOG, связанных с проведённой SBRS, который произошёл в подкожных тканях. Ни одного случая лучевой токсичности четвёртой степени не было зафиксировано. Исследователи отметили, что для 28 очагов на протяжении восемнадцати месяцев положительный эффект, включая истинную стабилизацию, составил 93%.
В 2009 году Rusthoven et al. опубликовали результаты многоцентрового (было проведено в период с августа 2003 г. по октябрь 2007 г. в 7 лечебных учреждениях) исследования I/II фазы применения SBRS у больных метастатическим поражением печени. В исследование были включены больные с 1-3 метастазами в печени и максимальным размером отдельных узлов менее 6 см. Учитывался исходный уровень билирубина, альбумина, протромбиновое и АЧТВ, активность печеночных ферментов. Не разрешалось 14 дней проводить химиотерапию до и после SBRS. Для 49 метастатических очагов показатели локального контроля составили 95% (через год после SBRS) и 92% (через два года после SBRS). У 2% больных, были выявлены лучевые повреждения третьей и выше степеней с медианой в 7,5 месяцев после стереотаксической радиохирургии. Двухлетние показатели положительного локального эффекта для метастазов диаметром до 3,0 см была равна
100%. Это наивысший из опубликованных показателей положительного эффекта, несмотря на то, что показатели двухлетней выживаемости составили 30%. Авторы дают заключение, что метод стереотаксической радиохирургии с суммарной дозой в 60 Гр за три фракции является как безопасным, так и эффективным для лечения пациентов с количеством печёночных метастазов от одного до трёх.
Van der Pool et al. в 2010 году представили исследование, в котором 20 пациентам с метастатическим поражением печени была проведена SBRS в дозах от 30 до 37,5 Гр за три фракции. Были получены стопроцентные показатели положительного локального эффекта через год после проведения лечения. Через два года этот показатель снизился до 74%, при этом средняя выживаемость составила 34 месяца. Среди лучевых повреждений обращают внимание один случай перелома ребра и 2 случая повышения печёночных ферментов III степени в качестве отдалённых последствий лучевой терапии.
Также в 2010 году были опубликованы результаты проспективного исследования Goodman et al. , в котором 26 пациентам со злокачественными опухолями печени (из них 19 - с метастатическим поражением) была проведена SBRS одной фракцией в размере 18-30 Гр. Показатели локального эффекта через 12 месяцев составили 77%. Двухлетняя выживаемость для пациентов с метастатическим поражением печени составила 49%.
В 2011 году, после технического перевооружения, в ФГБУ РОНЦ им. Н. Н. Блохина РАМН в клинической практике для лечения больных с метастатическим поражением печени внедрена методика локальной стереотаксической радиохирургии (SBRS). Методика позволяет создать локально в метастатическом опухолевом узле высокую дозу ионизирующего излучения и вызвать разрушение опухоли. Это перспективное направление в лечении метастатического рака печени значительно расширило возможности комбинированного лечения.
С августа 2010 года по июль 2013 года в радиологическом отделении ФГБУ РОНЦ им. Н. Н. Блохина РАМН SBRS проведена тридцати пяти пациентам с метастазами в печень опухолей различного гистологического строения. Разовая очаговая доза варьировалась от десяти до двадцати грей, радиохирургия проводилась
Возможности стереотаксической радиохирургии при лечении больных с метастатическим поражением печени
за три сеанса в течение 5-7 дней. Два пациента не представили данные контрольного обследования, ещё в двух случаях было зафиксировано локальное прогрессирование. У семи пациентов была отмечена полная регрессия опухоли, в тринадцати - частичная, и в одиннадцати - стабилизация пролеченных очагов. У пятерых пациентов впоследствии были выявлены новые метастатические очаги в областях печени, не подвергавшихся лечению. Медиана наблюдения составила 17 месяцев. Ни в одном из случаев не было зафиксировано ранних и поздних лучевых повреждений III-IV степеней, частота развития лучевых повреждений II степени составила 9%.
Заключение
Только при наличии современного оборудования и технологий, появляются перспективы в применении стереотаксической радиохирургии в лечении пациентов с метастатическим поражением печени. Данная технология является реальной альтернативой другим методам локального воздействия на метастатические образования. Приведённые данные зарубежных авторов, а также опыт радиологического отделения ФГБУ РОНЦ им. Н. Н. Блохина РАМН свидетельствуют о высокой эффективности и безопасности применения данной технологии даже у тех пациентов, которым отказано в других методах лечения.
Клинический случай
Пациентка А. 65 лет. Рак сигмовидной кишки, метастатическое поражение печени, T4N1M1, IV стадия.
07.06.10 пациентке была проведена паллиативная резекция сигмовидной кишки. 29.07.10 - левосторонняя гемигепатэктомия, резекция правой доли печени.
При гистологическом исследовании - аденокарцинома.
После операции было проведено 8 курсов химиотерапии.
В августе 2011 года по данным УЗИ от 15.08.11 выявлено прогрессирование заболевания в виде солитарного метастаза в оставшейся части печени.
По 17.11.11 было проведено 7 курсов химиотерапии.
По данным КТ от 26.10.11 между воротной и правой печёночной веной определяется образование до 2,7х2,5 см, в VII сегменте очаг до 0,9 см (Рис. 1).
По данным МРТ от 14.12.11 в зоне резекции в сегментах S5-S8 узел до 1,8 см, тесно при легающий к воротной вене. В сегментах S6-7 определяется узел до 0,5 см.
С 21.12.11 по 27.12.11 проведён курс стере-отаксической радиохирургии на оба очага в печени с использованием методики IMRT, РОД 15 Гр, 3 раза в неделю, СОД 45 Гр.
Фиксация пациентки производилась с помощью индивидуального вакуумного матраца,
верификация программы облучения производилась с использованием технологии компьютерной томографии в коническом пучке на столе линейного ускорителя в положении лечения.
По данным КТ от 15.05.12 отмечается появление нового очага в S6 печени размерами до 1,7 см. Два очага, подвергнутые сте-реотаксической радиотерапии не визуализируются (Рис. 2).
В дальнейшем пациентка получала лечение в Южной Корее. В июле 2012 и феврале 2013 года была произведена радиочастотная
абляция очага в S6 печени. Пациентка отмечала повышение температуры тела в течение долгого времени, на месте метастаза в S6 печени был выявлен абсцесс. 21.08.13 было произведено хирургическое вмешательство: в доступных визуализации областях печени без признаков злокачественного процесса, в зоне резецированного очага в сегменте S6 - опухолевые клетки по краю резекции.
На данный момент пациентка жива. По данным обследования от августа 2013 года признаки заболевания не обнаружены.
Литература
1. Hoyer M., Swaminath A., Bydder S., et al. Radiotherapy for liver metastases: a review of evidence. Int J Radiat Oncol Biol Phys. 2012. V. 82 (3). P. 1047-57.
2. Lax I., Blomgren H., Naslund I., et al. Stereotactic radiotherapy of malignancies in the abdomen. Methodological aspects. Acta Oncol. 1994. V. 32 P. 677-683.
3. Poston G. J. Surgical strategies for colorectal liver metastases. Surg Oncol 2004. V. 13. P. 125-36.
4. de Haas R. J., Wicherts D. A., Flores E., et al. R1 resection by necessity for colorectal liver
metastases: is it still a contraindication to surgery? Ann Surg. 2008. V. 248 (4). P. 626-37.
5. de Jong M. C., Mayo S. C., Pulitano C., et al. Repeat curative intent liver surgery is safe and effective for recurrent colorectal liver metastasis: results from an international multi-institutional analysis. J Gastrointest Surg. 2009. V. 13 (12). P. 2141-51.
6. Potters L., Kavanagh B., Galvin J. M., et al. American Society for Therapeutic Radiology and Oncology (ASTRO) and American College of Radiology (ACR) practice guideline for the performance of stereotactic body radiation therapy.
Возможности стереотаксической радиохирургии при лечении больных с метастатическим поражением печени
Int J Radiat Oncol Biol Phys. 2010. V. 76. P. 326-332.
7. Blomgren H., Lax I., Näslund I., Svanströ
m R. Stereotactic high dose fraction radiation therapy of extracranial tumors using an accelerator. Clinical experience of the first thirty one patients. Acta Oncol. 1995. V. 33. P. 861-70.
8. Blomgren H., Lax I., Goranson H., et al. Radiosurgery for tumors in the body: clinical experience using a new method. J Radiosurg. 1998. V. 1. P. 63-74.
9. Gunvén P, Blomgren H, Lax I. Radiosurgery for recurring liver metastases after hepatectomy. Hepatogastroenterology. 2003. V. 50 (53).
10. Dawson L. A., McGinn C. J., Normolle D., et al. Escalated focal liver radiation and concurrent hepatic artery fluorodeoxyuridine for unresectable intrahepatic malignancies. J Clin Oncol. 2000.
V. 18. P. 2210-2218.
11. Dawson L. A., Normolle D., Balter J. M., et al. Analysis of radiationinduced liver disease using the Lyman NTCP model. Int J Radiat Oncol Biol Phys. 2002. V. 53 (4). P. 810-821.
12. Herfarth K. K., Debus J., Lohr F., et al. Stereotactic Single-Dose Radiation Therapy of Liver Tumors: Results of a Phase I/ II Trial. Journal of Clinical Oncology. 2001. V. 19. P. 164-170.
13. Wulf J., Guckenberger M., Haedinger U., et al. Stereotactic radiotherapy of primary liver cancer
and hepatic metastases. Acta Oncol. 2006. V. 45 (7). P. 838-47.
14. Hoyer M., Roed H., Hansen A. T., et al. Phase II study on stereotactic body radiotherapy of colorectal metastases. Acta Oncol. 2006. V. 45. P. 823-830.
15. Schefter T. E., Kavanagh B. D., Timmerman R. D., et al. A phase I trial of stereotactic body radiation therapy (SBRT) for liver metastases. Int J Radiat Oncol Biol Phys. 2005. V. 62. P. 1371-1378.
16. Kavanagh B. D., Schefter T. E., Cardenes H. R., et al. Interim analysis of a prospective phase I/II trial of SBRT for liver metastases. Acta Oncol. 2006. V. 45. P. 848-855.
17. Rusthoven K. E., Kavanagh B. D., Cardenes H., et al. Multi-institutional Phase I/ II trial of stereotactic body radiation therapy for liver metastases. J Clin Oncol. 2009. V. 27. P. 1572-1578.
18. van der Pool A. E., Mendez Romero A., Wunderink W., et al. Stereotactic body radiation therapy for colorectal liver metastases. Br J Surg. 2010. V. 97. P. 377-382.
19. Goodman K. A., Wiegner E. A., Maturen K. E., et al. Dose-escalation study of single-fraction stereotactic body radiotherapy for liver malignancies. Int J Radiat Oncol Biol Phys. 2010. V. 78. P. 486-493.